
【题目】与卤素单质化学性质相似的物质称为拟卤素或类卤素,如氰气,它的结构式为N≡C—C≡N,下列说法不正确的是( )
A. 其中叁键的键长比单键要短 B. 分子中含3个σ键和4个π键
C. 分子构型为直线形 D. 可以发生加成反应,但不能与氢氧化钠溶液反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于原子结构与元素性质的说法正确的是( )
A. 同种元素的原子均有相同的质子数和中子数
B. 全部由非金属元素组成的化合物中只含共价键
C. ⅦA族元素是同周期中非金属性最强的元素
D. 同一主族的元素,原子半径越大,其单质的熔点一定越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 3 mol·L-1的KClO3 B. 75 mL 2 mol·L-1的NH4Cl
C. 350 mL 3 mol·L-1的NaCl D. 150 mL 0.5mol·L-1的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:

已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________(任写一种)。请写出其中发生的氧化还原反应离子方程式: _________。滤渣的成分为S单质和_________。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O![]() Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
(3) 简述检验沉淀是否洗净的实验方法: _________,若未出现浑浊则证明沉淀己洗干净,反之则没有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一周期的X、Y、Z三种元素,已知它们最高价氧化物对应水化物的酸性强弱是H3XO4<H2YO4<HZO4,下列推断不正确的是( )
A. 原子序数:X<Y<Z B. 气态氢化物稳定性:XH3<H2Y<HZ
C. 元素的非金属性强弱:X>Y>Z D. 最外层电子数:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需克服相同类型作用力的是( )。
A. 碘和干冰的升华 B. Na2O2和C60的熔化
C. 氯化氢和氯化钾的溶解 D. 溴的气化和NH4Cl加热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 中和 100mL 1mol· L-1 的 H2SO4 溶液,需 NaOH 的质量为8g
B. 从 1 L 2mol· L-1 的 H2SO4 溶液中取出 0.5L,剩余溶液的浓度仍2mol· L﹣1
C. 制成 0.5L 10molL-1 的盐酸,需标准状况下氯化氢气体 112L
D. 1 L 水中溶解了58.5g NaCl,该溶液的物质的量浓度为 1mol· L -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
(1)①1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是_______________________________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
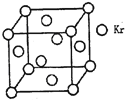
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中通入a mol X气体并发生反应:2X(g) ![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
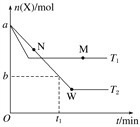
A. 正反应方向为放热反应
B. 在T2温度下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C. M点的正反应速率v正大于N点的逆反应速率v逆
D. W点时再加入一定量X,平衡后X的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com