
【题目】下列物质中,在一定条件下既能起加成反应,又能起取代反应,但不能使KMnO4酸性溶液褪色的是( )
A.苯B.乙烷C.乙烯D.乙醇
科目:高中化学 来源: 题型:
【题目】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、![]() (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
(1)①1mol PAN中含有的σ键数目为_______。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是_______________________________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
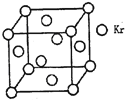
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中通入a mol X气体并发生反应:2X(g) ![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
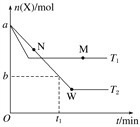
A. 正反应方向为放热反应
B. 在T2温度下,在0~t1时间内,v(Y)=![]() mol·L-1·min-1
mol·L-1·min-1
C. M点的正反应速率v正大于N点的逆反应速率v逆
D. W点时再加入一定量X,平衡后X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“瘦肉精”是一种能减少脂肪增加瘦肉的药品,有很危险的副作用,轻则导致心律不齐,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是( )
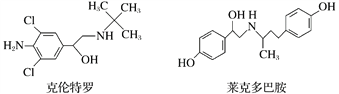
A. 克伦特罗分子的分子式为C12H18ON2Cl2
B. 克伦特罗能发生加成、氧化、消去等反应
C. 克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D. 莱克多巴胺与足量NaOH溶液反应,生成物的化学式为C18H20NO3Na3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:3A(g)![]() 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是( )
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是( )
A. 若x=2,则p>0.5a B. 若x=3,则p>0.7a
C. 若x=4,则p= a D. 若x= 5,则p≥a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.1 mol/L的NaOH溶液,下列操作会使实验结果偏低的是
A. 移液前容量瓶内有水珠 B. 用滤纸称量NaOH固体
C. 摇匀后,液面低于刻度线 D. 定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,下列有关电解质溶液的描述正确的是
A.等浓度的KHSO3溶液与KOH溶液等体积混合:c(OH)c(H+)=c(![]() ) + c(H2SO3)
) + c(H2SO3)
B.pH相同的氨水和Ba(OH)2溶液中:2c(![]() )= c(Ba2+)
)= c(Ba2+)
C.等浓度的Na2SO4溶液与NH4Cl溶液等体积混合:c(Na+) +c(![]() )+c(NH3·H2O)=2c(
)+c(NH3·H2O)=2c(![]() ) +c(Cl)
) +c(Cl)
D.1 L 0.1 mol·L1的KAl(SO4)2·12H2O溶液中:c(K+)+c(Al3+)+c(H+)=c(OH)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,16g CH4含有CH4分子数为NA
B. 常温常压下,22.4L CO2含有CO2分子数为NA
C. 1mol Na燃烧生成Na2O2失去的电子数为2NA
D. 0.5mol·L-1 的CuCl2溶液中含Cl-数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银是一种美丽的银白色的金属,其导电性和导热性非常好,银及其合金广泛应用于电子电器材料、感光材料、化工材料等方面。
(1)银与铜同族,铜元素在周期表中的位置是__________。基态铜原子的电子排布式是____________________。
(2)Ag+能与NH3、![]() 、CN等形成配位数为2的配合物。
、CN等形成配位数为2的配合物。
①C、N、O三种元素的第一电离能从大到小的顺序为__________。
②利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有__________(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③![]() 中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与
中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与![]() 、SO2互为等电子体的短周期元素单质分子的化学式__________。
、SO2互为等电子体的短周期元素单质分子的化学式__________。
(3)银晶体的晶胞如图所示,为面心立方最密堆积,则银原子的配位数为__________。
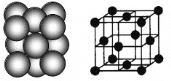
晶体空间利用率是指构成晶体的微粒在整个晶体空间中所占的体积分数,即空间利用率=![]() ×100%。则银晶体的空间利用率为__________(保留2位有效数字,
×100%。则银晶体的空间利用率为__________(保留2位有效数字,![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com