
【题目】只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液,这种试剂是
A. NaHCO3溶液 B. 新制Cu(OH)2悬浊液
C. 石蕊试液 D. 溴水
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。

(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ,

②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为__________;
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.11.2 L CO2所含分子数为0.5 NA
B.1 L 0.1 molL﹣1的Na2S溶液中离子数为0.3 NA
C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S![]() HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
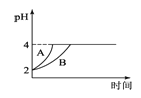
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)称取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L,反应的离子方程式为 。
(2)称取同样的a g样品,在高温下恰好完全反应。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比,c:b为_______________。
根据上述实验可确定该铝热剂中含Al的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色。

请回答下列问题:
(1)框图中所列物质中属于非电解质的物质是_____________;
(2)将D的水溶液蒸干并灼烧得到的固体物质的化学式为___ _______;
(3)在一定物质的量浓度的硝酸铵溶液中滴加适量的K溶液,使溶液的pH=7,则溶液中c(Na+)_______c(NO3―)(选填“>”“=”或“<”)。
(4)①4 g J在纯氧中完全燃烧生成液态化合物,放出热量为QkJ,写出表示J燃烧热的热化学方程式 。
②A是重要的化工原料,工业上制取A的反应的化学方程式为___________。
(5)与F组成元素相同的一种-2价酸根离子M,M中两种元素的质量比为4∶3,已知1 mol A单质与含1 mol M的溶液能恰好完全反应,反应时仅观察到有浅黄色沉淀产生。取反应后的上层清液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。则A单质与含M的溶液反应的离子方程式为:_______ 。
(6)25℃时,若Ksp(H)=2.2×10-20,向0.022mol/L的E溶液中逐滴滴入溶液K,当开始出现沉淀时,溶液中的c(OH-)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的__ 。
(2)根据下列描述写出下列化学方程式:
①已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素【CO(NH2)2】和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成,现利用如图所示流程,以环己烯为原料合成环醚、聚酯和合成橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1HC=CHR2→R1-CHO+R2-CHO
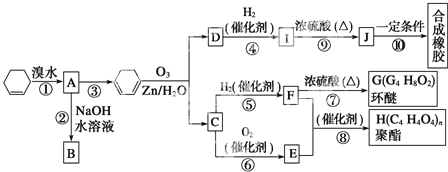
(1)③的反应条件是_______________________。
(2)H的名称是_________________________。
(3)有机物B和I的关系为_____(填序号)。
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(4)写出反应⑩的化学方程式:________________。
(5)写出两种D的属于酯类的链状同分异构体的结构简式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com