
【题目】将10.6gNa2CO3溶于水配成1L溶液.
(1)该溶液中Na2CO3的物质的量浓度为 , 溶液中Na+的物质的量浓度为
(2)向该溶液中加入一定量的NaCl 固体,使溶液中Na+ 的物质的量浓度为0.4molL﹣1(假设溶液体积不变)需加入NaCl的质量为 , Cl﹣ 的物质的量浓度为 .
【答案】
(1)0.1mol/L;0.2mol/L
(2)11.7g;0.2mol/L
【解析】解:(1)碳酸钠物质的量= ![]() =0.1mol,故溶液中c(Na2CO3)=
=0.1mol,故溶液中c(Na2CO3)= ![]() =0.1mol/L,溶液中c(Na+)=2c(Na2CO3)=0.1mol/L×2=0.2mol/L,所以答案是:0.1mol/L;0.2mol/L;(2)Na+ 的物质的量=1L×0.4mol/L=0.4mol,故加入NaCl物质的量=0.4mol﹣0.1mol×2=0.2mol,故加入氯化钠的质量=0.2mol×58.5g/mol=11.7g,溶液中c(Cl﹣)=
=0.1mol/L,溶液中c(Na+)=2c(Na2CO3)=0.1mol/L×2=0.2mol/L,所以答案是:0.1mol/L;0.2mol/L;(2)Na+ 的物质的量=1L×0.4mol/L=0.4mol,故加入NaCl物质的量=0.4mol﹣0.1mol×2=0.2mol,故加入氯化钠的质量=0.2mol×58.5g/mol=11.7g,溶液中c(Cl﹣)= ![]() =0.2mol/L,所以答案是:11.7g;0.2mol/L.
=0.2mol/L,所以答案是:11.7g;0.2mol/L.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子  的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物 ![]() (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象.可以通过下列装置所示实验进行探究.下列说法正确的是( ) 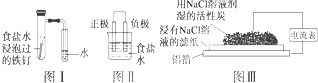
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl﹣由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl﹣﹣2e﹣═Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3 , 而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl﹣、H+中,具有氧化性的是 , 其中氧化性强的是 .
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现有如下三个反应,请写出盐酸在三个反应中,分别表现什么性质:①NaOH+HCl═NaCl+H2O;
②2HCl ![]() H2↑+Cl2↑ .
H2↑+Cl2↑ .
③MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O .
MnCl2+Cl2↑+2H2O .
(3)并用“双线桥法”标出反应③电子转移的方向和数目 .
(4)在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,写出反应的化学方程式(不必配平) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量不超过100的有机物A,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 A完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。
① 其A的相对分子质量为________________
② A的实验式为_____________
③经核磁共振检测发现A的氢谱图如下,写出A的结构简式:_____________

④试写出A与甲醇反应的化学反应方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)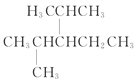 名称为:________________________________
名称为:________________________________
(4)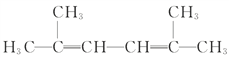 名称为:_______________
名称为:_______________
(5)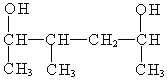 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如下图所示,下列说法不正确的是( )
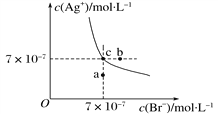
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,往AgBr饱和溶液加入KI固体,会产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3 , 含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: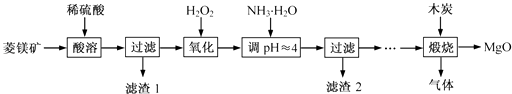
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2 氧化时,发生反应的化学方程式为 .
(3)滤渣2 的成分是(填化学式).
(4)煅烧过程存在以下反应:2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.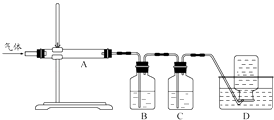
①D中收集的气体可以是(填化学式).
②B中盛放的溶液可以是(填字母).
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PHB是一种树脂,有机物K是一种抗惊厥药物,它们的合成路线如图: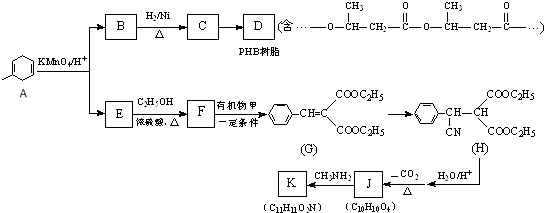
已知:R、R′、R″代表烃基
①RCN ![]() RCOOH
RCOOH
② ![]()
![]() RCOOH+
RCOOH+ ![]()
③ 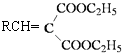
![]()
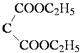 +H2O
+H2O
(1)B→C的反应类型是 .
(2)写出一定条件下C→D的化学方程式: .
(3)有机物甲的结构简式为 .
(4)写出E→F的化学方程式: .
(5)已知1mol J最多与2mol NaHCO3反应;K分子结构中含有一个五元环与一个六元环.写出一定条件下J→K的化学方程式: .
(6)S是A的一种同分异构体,分子中没有环状结构,S的核磁共振氢谱有三个峰,峰面积之比为6:3:1,则S的结构简式为(写出一种即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com