
【题目】根据所学知识完成下面题目:
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3 , 而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl﹣、H+中,具有氧化性的是 , 其中氧化性强的是 .
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现有如下三个反应,请写出盐酸在三个反应中,分别表现什么性质:①NaOH+HCl═NaCl+H2O;
②2HCl ![]() H2↑+Cl2↑ .
H2↑+Cl2↑ .
③MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O .
MnCl2+Cl2↑+2H2O .
(3)并用“双线桥法”标出反应③电子转移的方向和数目 .
(4)在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,写出反应的化学方程式(不必配平) .
【答案】
(1)Cl2、H+;Cl2
(2)酸性;既表现氧化性又表现还原性;酸性和还原性
(3)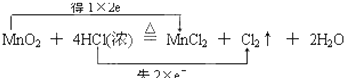
(4)2FeCl3+H2S═2FeCl2+S↓+2HCl
【解析】解:(1)在Cl2、Cl﹣、H+中氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+ , 其中氧化性最强的是Cl2 , 所以答案是:Cl2、H+;Cl2;(2)①NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;所以答案是:酸性;②2HCl ![]() H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl既表现氧化性又表现还原性,所以答案是:既表现氧化性又表现还原性;③反应MnO2+4HCl(浓
H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl既表现氧化性又表现还原性,所以答案是:既表现氧化性又表现还原性;③反应MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O中,Cl元素的化合价升高,盐酸表现还原性,且生成氯化锰,盐酸表现酸性,所以答案是:酸性和还原性;(3)Mn元素的化合价从+4价降为+2价,Cl元素从﹣1价升高为0价,可通过双线桥分析此氧化还原反应,
MnCl2+Cl2↑+2H2O中,Cl元素的化合价升高,盐酸表现还原性,且生成氯化锰,盐酸表现酸性,所以答案是:酸性和还原性;(3)Mn元素的化合价从+4价降为+2价,Cl元素从﹣1价升高为0价,可通过双线桥分析此氧化还原反应, 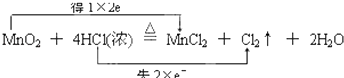 ,所以答案是:
,所以答案是: 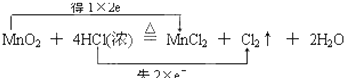 ;(4)已知H2S为反应物,则反应为H2S→S,则另一反应物应具有氧化性,应为FeCl3 , 则发生反应为2FeCl3+H2S═2FeCl2+S↓+2HCl,所以答案是:2FeCl3+H2S═2FeCl2+S↓+2HCl.
;(4)已知H2S为反应物,则反应为H2S→S,则另一反应物应具有氧化性,应为FeCl3 , 则发生反应为2FeCl3+H2S═2FeCl2+S↓+2HCl,所以答案是:2FeCl3+H2S═2FeCl2+S↓+2HCl.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案不可行或结论不正确的是( )
A.用润湿的pH试纸测定饱和Na2CO3溶液pH
B.通过观察如图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀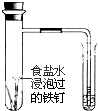
C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2
D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C7H16O的饱和一元醇的同分异构体有多种,在下列该醇的同分异构体中, 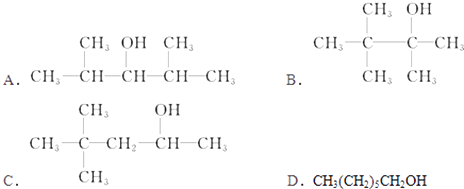
(1)可以发生消去反应,生成两种单烯烃的是(用符号表示)
(2)可以发生催化氧化反应生成醛的是(用符号表示)
(3)不能发生催化氧化反应的是(用符号表示)
(4)能被催化氧化为酮的有种.
(5)能使酸性高锰酸钾溶液褪色的有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。说法正确的是
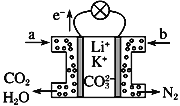
A. a为CH4,b为CO2 B. CO![]() 向正极移动
向正极移动
C. 此电池在常温时也能工作 D. 正极电极反应式为O2+2CO2+4e-===2CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,2gH2含有的氢原子数目为2NA
B.标准状况下,22.4LCCl4中含有的分子数为NA
C.标准状况下,20gD2O中含有的电子数为10NA
D.常温常压下,1molL﹣1K2CO3溶液中含有的钾离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
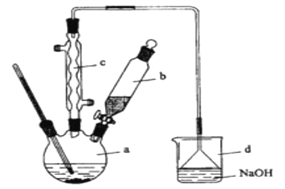
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体。继续滴加至液溴滴完。装置d的作用是_____________;制取溴苯的化学方程式___________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是:____________________。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.6gNa2CO3溶于水配成1L溶液.
(1)该溶液中Na2CO3的物质的量浓度为 , 溶液中Na+的物质的量浓度为
(2)向该溶液中加入一定量的NaCl 固体,使溶液中Na+ 的物质的量浓度为0.4molL﹣1(假设溶液体积不变)需加入NaCl的质量为 , Cl﹣ 的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:; 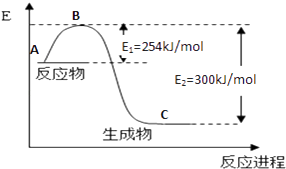
(2)若已知下列数据:
化学键 | H﹣H | N≡N |
键能/kJmol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能kJmol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 , E2(填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如 4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2 , 则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量反应的离子方程式书写正确的是( )
A.氢氧化镁与稀盐酸反应:H++OH﹣═H2O
B.氯化钡溶液与硫酸钠溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
C.FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+
D.碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com