
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。说法正确的是
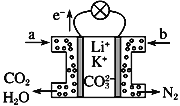
A. a为CH4,b为CO2 B. CO![]() 向正极移动
向正极移动
C. 此电池在常温时也能工作 D. 正极电极反应式为O2+2CO2+4e-===2CO![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向碳酸氢钠溶液中加入氢氧化钙溶液时,溶液没有浑浊
B. 夏日的傍晚常常看到万丈霞光,该现象属于胶体的丁达尔效应
C. 过氧化钠是一种强氧化剂,不可作为氧气来源
D. 胶体和浊液的分散质都不能通过滤纸的孔隙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池是二十世纪九十年代发展起来的一种新型绿色电池,具有高能量、长寿命、无污染等特点。用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。电池的总反应式为:


(如图) (如图)
(1)①镍氢电池充电时,镍电极连接直流电源的___________极。阳极的电极反应式为____________。
②镍氢电池放电时,OH-移向____________(填“碳电极”或“镍电极”)。
(2)除了用纳米碳管等材料储氢外,还可使用有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢。一定条件下,利用如图装置可实现有机物的电化学储氢(忽略其它有机物)。
①A为电源的____________极。
②电极E上产生的气体为____________。
③电极D的电极反应式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机物的说法中正确的是 ( )
A. 溴乙烷和乙烷都是烃 B. 苯和甲烷可以使酸性KMnO4溶液褪色
C. 甲烷和乙烯都可以与氯气反应 D. 乙烯可以与氢气发生加成反应,但苯不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
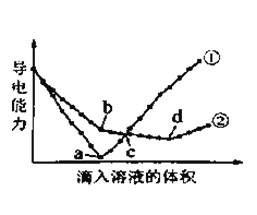
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、A1、Cu是生活中常用的金属。
(1)基态Cu原子核外电子排布式为_____________,基态Fe2+核外有_________个未成对电子。
(2)①re、Al、Cu三种元素第一电离能由高到低的顺序为___________________。
②Mn和Fe的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/kJ mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是_____________。
(3)铁可形成多种配合物,如[Fe(CN)6]4-、Fe(CO)5等,lmol Fe(CN)43-中含有σ键的数目为________;Fe(CO)5熔点为-20.5℃,沸点为103℃:易溶于CCl4,据此可以判断Fe(CO)3晶体属于________ (填晶体类型)。
(4)下列变化过程中,破坏的力的作用类型相同的是_____________;(填字母代号)。
A.铝气化 B.A1C13溶于水 C.加热使铜熔化 D.熔融NaC1
(5)Fe能与N形成一种磁性材料,其晶胞结构如图所示:

①该磁性材料的化学式为__________________;
②Fe原子的坐标参数为(![]() ,
, ![]() ,0)、(
,0)、(![]() ,0,
,0, ![]() )、________、(0,0,0),N原子的坐标参数为_______。
)、________、(0,0,0),N原子的坐标参数为_______。
③已知该晶体的晶胞参数α pm,列出其密度表达式为_________g cm-3(用含α的式子表示,只列式子,不作计算。)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁的基本反应之一是:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ;△H>0。其平 衡常数K=
Fe(s)+CO2(g) ;△H>0。其平 衡常数K=![]() ,且K(1100℃)=0.263。
,且K(1100℃)=0.263。
(1) 温度升高,平衡常数K的值______,高炉内CO2和CO的体积比值______(填 “增大”、“减小”、“不变”)
(2)在1100℃时,测得某高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L。这种情 况下,该反应是否处于平衡状态?答:_____(填“是”、“否”)。此时,化学反应速率是V(正)__________V(逆)(填“大于”、“等于”、“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是
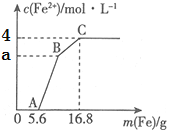
A. 原溶液的c(H+)=4mol·L—1
B. 若a=3,则原溶液中c(Cu2+)=1mol·L—1
C. 原溶液中的c(NO3-)=7mol·L-1
D. BC段发生反应的离子方程式为Cu2++Fe=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2![]() 2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:
2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:

①300℃时,平衡常数K=________,升高温度,K值______(填“增大”、“减小”或“不变”)。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)=______________。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是________。
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
④已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
II、如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。

III、现有反应:mA(g)+nB(g)![]() pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)若加入B(体积不变),则A的转化率______。
(2)若升高温度,则平衡时B、C的浓度之比![]() 将________。
将________。
(3)若加入催化剂,平衡时气体混合物的总物质的量__________。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________,
而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、“变浅”或“不变”)。
(5)在固定容积的密闭容器中能说明反应己达平衡状态的是______________。
A.浓度pc(B)=nc(C) B.容器内压强保持不变
C.pv逆(B)=n v正(C) D.容器内的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com