
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:; 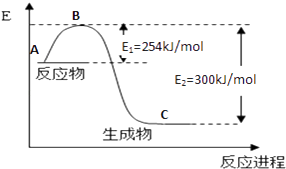
(2)若已知下列数据:
化学键 | H﹣H | N≡N |
键能/kJmol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能kJmol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 , E2(填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如 4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2 , 则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)
【答案】
(1)N2(g)+3H2(g)?2NH3(g)△H=﹣92kJ/mol
(2)390
(3)减小;减小
(4)![]()
【解析】解:(1)反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46kJ热量,则反应的热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92kJ/mol, 故答案为:N2(g)+3H2(g)2NH3(g)△H=﹣92kJ/mol;(2)反应热等于反应物的总键能减去生成物的总键能,设N﹣H的键能为x,
则943+3×435﹣6x=﹣92,x=390,故答案为:390;(3)加入催化剂,反应物和生成物的活化能都降低,故答案为:减小;减小;(4)已知①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol②N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
利用盖斯定律将 ![]() 可得NH3(g)+
可得NH3(g)+ ![]() NO(g)=
NO(g)= ![]() N2(g)+
N2(g)+ ![]() H2O(g)△H3=
H2O(g)△H3= ![]() kJ/mol,
kJ/mol,
故答案为: ![]() .
.
(1)先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;(2)根据反应热等于反应物的总键能减去生成物的总键能计算;(3)加入催化剂,反应物和生成物的活化能都降低;(4)利用盖斯定律计算.


科目:高中化学 来源: 题型:
【题目】以下说法不正确的是( )
A.1mol乙醇可以与足量金属钠反应,生成0.5molH2 , 能证明乙醇分子有一个H原子与其余的H原子不同
B.下列反应可证明苯环受甲基的影响,甲苯易被酸性高锰酸钾氧化 ![]()
C.下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易 
D.苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3 , 而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl﹣、H+中,具有氧化性的是 , 其中氧化性强的是 .
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现有如下三个反应,请写出盐酸在三个反应中,分别表现什么性质:①NaOH+HCl═NaCl+H2O;
②2HCl ![]() H2↑+Cl2↑ .
H2↑+Cl2↑ .
③MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O .
MnCl2+Cl2↑+2H2O .
(3)并用“双线桥法”标出反应③电子转移的方向和数目 .
(4)在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,写出反应的化学方程式(不必配平) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)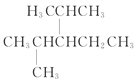 名称为:________________________________
名称为:________________________________
(4)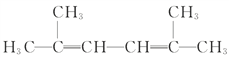 名称为:_______________
名称为:_______________
(5)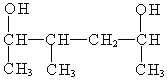 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如下图所示,下列说法不正确的是( )
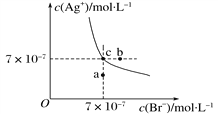
A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,往AgBr饱和溶液加入KI固体,会产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3 , 含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: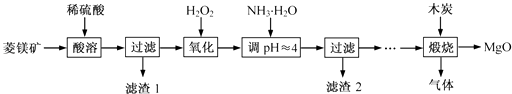
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2 氧化时,发生反应的化学方程式为 .
(3)滤渣2 的成分是(填化学式).
(4)煅烧过程存在以下反应:2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.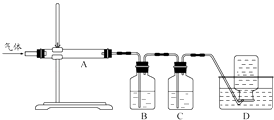
①D中收集的气体可以是(填化学式).
②B中盛放的溶液可以是(填字母).
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(I)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH3+ ) B.碳负离子(CH3﹣) C.甲基 (﹣CH3) D.碳烯(:CH2)
①四种微粒中,键角为120°的是(填序号).
②碳负离子(CH3﹣)的空间构型为 , 与CH3﹣互为等电子体的一种分子是(填化学式).
(II )在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①C、N、O的电负性由大到小的顺序为 .
②写出Cu的核外电子排布式 .
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为 .
④在一定条件下NH3和CO2能合成尿素CO(NH2)2 , 尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为 .
⑤Cu2O晶体的晶胞结构如图所示,若阿伏伽德罗常数为NA , 晶胞的边长为apm,则晶体的密度为gcm﹣3 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色未知溶液中检验出有Ba2+、Ag+ , 同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Fe3+ ③Cl﹣ ④NO ![]() ⑤S2﹣ ⑥CO
⑤S2﹣ ⑥CO ![]() ⑦NH
⑦NH ![]() ⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
A.③⑤⑥⑦⑨
B.①②⑤⑥⑧
C.③④⑦⑧⑨
D.①②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com