
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
A. ①② B. ①③ C. ①④ D. ②③
考点: 钠的重要化合物;硅和二氧化硅;镁、铝的重要化合物.
专题: 元素及其化合物.
分析: ①二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠的溶解度;
②偏铝酸钠和盐酸反应生成氢氧化铝和氯化钠,氢氧化铝和盐酸反应生成氯化铝和水;
③向AlCl3溶液中逐滴加入氢氧化钠,先生成氢氧化铝,氢氧化钠过量时氢氧化铝继续反应生成偏铝酸钠;
④盐酸和硅酸钠反应生成难溶性的硅酸,硅酸和盐酸不反应.
解答: 解:①向饱和碳酸钠溶液中通入过量的CO2,碳酸钠和二氧化碳、水反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,原碳酸钠溶液是饱和溶液,生成碳酸氢钠后溶液变成过饱和溶液,所以会析出部分碳酸氢钠晶体,所以不出现“先产生沉淀,然后沉淀又溶解”现象,故正确;
②向NaAlO2胶体中逐滴加入过量的稀盐酸,偏铝酸钠先和盐酸反应生成难溶性的氢氧化铝,氢氧化铝是两性氢氧化物能溶于强酸溶液,所以氢氧化铝和盐酸能继续反应生成可溶性的氯化铝,所以出现“先产生沉淀,然后沉淀又溶解”现象,故错误;
③AlCl3溶液中滴入氢氧化钠溶液,开始AlCl3可以和氢氧化钠反应生成氢氧化铝沉淀,然后氢氧化铝可以溶解于过量氢氧化钠中,所以出现“先产生沉淀,然后沉淀又溶解”现象,故错误;
④向硅酸钠溶液中逐滴加入过量的盐酸,盐酸和硅酸钠反应生成难溶性的硅酸,硅酸和盐酸不反应,所以不出现“先产生沉淀,然后沉淀又溶解”现象,故正确;
故选C.
点评: 本题考查物质之间的化学反应,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意有些反应与反应物的量有关,量不同反应现象不同.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
化学与科技、社会、生活、生产密切结合,下列有关说法不正确的是( )
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.误食重金属盐而引起的中毒,急救方法是服用大量的豆浆或牛奶
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞一臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加人净水剂明矾可以使海水淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

A.b代表0℃下CH3COCH3的Y﹣t曲线
B.反应进行到20min末,CH3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
查看答案和解析>>
科目:高中化学 来源: 题型:
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
Na Cu Al Fe
熔点(℃) 97.5 1083 660 1535
沸点(℃) 883 2595 2200 3000
你判断其中不能形成合金的是( )
A. Cu和Al B. Fe和Cu C. Fe和Na D. Al和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是( )
A. 9:4 B. 1:1 C. 7:6 D. 6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 最终溶液:c(Na+)=1.5mol/L
B. 标准状况下,反应过程中得到6.72 L气体
C. 最终溶液:c(Na+)=c(Cl﹣)
D. 最终得到7.8 g沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
|
| A. | N2的电子式: |
|
| B. | S2﹣的结构示意图: |
|
| C. | 质子数为53,中子数为78的碘原子: |
|
| D. | 邻羟基苯甲酸的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧是地壳中含量最多的元素
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内O﹣H键、分子间的范德华力和氢键从强到弱依次为 . 沸点比
沸点比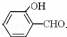 高,原因是 形. .
高,原因是 形. .
(3)H+可与H2O形成H3O+,H3O+中O原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因是 .
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO的密度为ag•cm﹣3,NA表示阿伏家的罗常数,则CaO晶胞的体积为 .
cm3.
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是 一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。
一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。 工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,其中Na2SO3被氧化为Na2SO4 。在以上反应中,NaClO3和Na2SO3的物质的量之比为
工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,其中Na2SO3被氧化为Na2SO4 。在以上反应中,NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com