
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 最终溶液:c(Na+)=1.5mol/L
B. 标准状况下,反应过程中得到6.72 L气体
C. 最终溶液:c(Na+)=c(Cl﹣)
D. 最终得到7.8 g沉淀
考点: 有关混合物反应的计算.
分析: 15.6gNa2O2的物质的量为: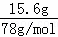 =0.2mol,5.4gAl的物质的量为:
=0.2mol,5.4gAl的物质的量为: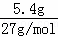 =0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol﹣0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为:
=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol﹣0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为: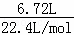 =0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol﹣0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,
=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol﹣0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,
A.根据钠离子守恒可知最终溶液中钠离子的物质的量为0.4mol,根据c=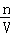 计算出钠离子浓度;
计算出钠离子浓度;
B.根据过氧化钠与水反应及铝与氢氧化钠反应计算生成氧气、氢气的总体积;
C.根据最终溶液中溶质为NaAlO2、NaCl分析;
D.根据m=nM计算生成的氢氧化铝的质量.
解答: 解:15.6gNa2O2的物质的量为: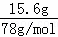 =0.2mol,5.4gAl的物质的量为:
=0.2mol,5.4gAl的物质的量为: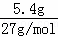 =0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol﹣0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为:
=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol﹣0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为: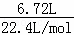 =0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol﹣0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,
=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol﹣0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,
A.反应后溶液的成分是0.3molNaCl和0.1molNaAlO2,根据质量守恒定律可知钠离子物质的量为0.4mol,则钠离子的浓度为: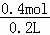 =2mol/L,故A错误;
=2mol/L,故A错误;
B.过氧化钠与水反应生成氧气为0.2mol× =0.1mol,铝与氢氧化钠反应生成氢气为0.2mol×
=0.1mol,铝与氢氧化钠反应生成氢气为0.2mol×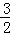 =0.3mol,故生成气体的体积为(0.1mol+0.3mol)×22.4L/mol=8.96L,故B错误;
=0.3mol,故生成气体的体积为(0.1mol+0.3mol)×22.4L/mol=8.96L,故B错误;
C.最终溶液中溶质为NaAlO2、NaCl,则钠离子浓度大于氯离子浓度,故C错误;
D.最终生成Al(OH)3为0.1mol,质量为:0.1mol×78g/mol=7.8g,故D正确,
故选D.
点评: 本题考查混合物的计算、钠的化合物与铝单质及化合物的性质等知识,题目难度中等,根据过量计算判断发生的反应是解题的关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2的化学方程式如下:2NO+2CO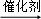 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
 请回答:以下各题(均不考虑温度变化对催化效率的影响):
请回答:以下各题(均不考虑温度变化对催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速度v(N2)= .
(3)假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是 .
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
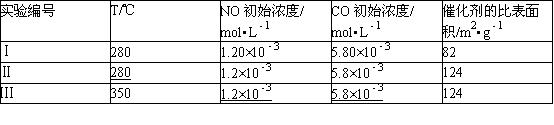 ①请在空格﹣﹣﹣﹣中填入剩余的实验条件数据.
①请在空格﹣﹣﹣﹣中填入剩余的实验条件数据.
②请在给出的坐标图中,画出表中的Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.(见答题纸)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NH3和HCl都能用来作喷泉实验的气体,若在同温同压下用等体积烧瓶各收集满NH3和HCl气体,实验后两个烧瓶内溶液的关系是(两烧瓶内充满溶液且不考虑溶质的扩散)( )
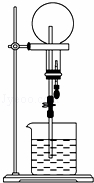
A. 溶质的物质的量浓度相同、溶质的质量分数不同
B. 溶质的质量分数相同,溶质的物质的量浓度不同
C. 溶质的物质的量浓度和溶质的质量分数都不同
D. 溶质的物质的量浓度和溶质的质量分数都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
A. ①② B. ①③ C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在人类生活中扮演着重要角色,以下应用正确的是( )
|
| A. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
|
| B. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 |
|
| C. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 |
|
| D. | 天然药物无任何毒副作用,可长期服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
|
| A. | 三者对应的氧化物均为碱性氧化物 |
|
| B. | 三者的单质放置在空气中均只生成氧化物 |
|
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
|
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质④不锈钢和目前流通的硬币都是合金⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑥豆浆和雾都是胶体。上述说法正确的是( )
A.①③④⑥ B.①⑤⑥ C.①②④⑤ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应在生产和生活中使用非常广泛。
一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。
A. Fe B. Fe2+ C. Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。
A. H2O B. O2 C. FeCl3 D.铁粉
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________性。
(4)NaHSO4在水中的电离方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com