
【题目】现以C8H18为原料经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,结合有关知识回答问题:
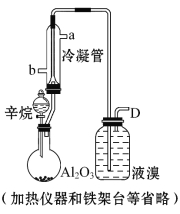
(1)生成乙烯的化学方程式为 , 。
(2)生成1,2-二溴乙烷的化学方程式是 。
(3)使用冷凝管的目的是 ,
冷凝管的进、出水方向为 。
(4)设计三种简单的实验证明广口瓶内发生的是加成反应而不是取代反应:
①第一种: 。
②第二种: 。
③第三种: 。
【答案】(1)C8H18![]() C4H10+C4H8
C4H10+C4H8
C4H10![]() C2H4+C2H6
C2H4+C2H6
(2)CH2=CH2+Br2![]()
(3)使辛烷冷凝回流 b处进水,a处出水
(4)①向广口瓶中加入适量AgNO3溶液,无淡黄色沉淀生成,证明是加成反应
②向广口瓶中加入适量紫色石蕊溶液,溶液不变红,证明是加成反应
③用pH试纸测定广口瓶中试剂的pH,不显酸性,证明是加成反应
【解析】C8H18裂解反应有C8H18![]() C4H10+C4H8、C4H10
C4H10+C4H8、C4H10![]() C2H4+C2H6,乙烯与Br2发生反应生成1,2-二溴乙烷的化学方程式为CH2=CH2+Br2
C2H4+C2H6,乙烯与Br2发生反应生成1,2-二溴乙烷的化学方程式为CH2=CH2+Br2![]() 。
。
证明广口瓶内发生的是加成反应可用反证法,若为取代反应,则有HBr生成,可用AgNO3溶液、紫色石蕊溶液、pH试纸检验。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】用石油和煤可以得到有机化工生产中需要的众多原料,如由石油裂解得到的乙烯和由煤干馏得到的苯制聚苯乙烯。生产过程如下:
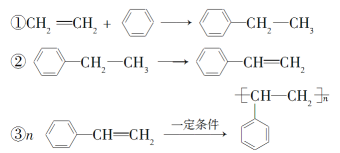
下列说法不正确的是( )
A. 通过裂解可以从石油中获得很多重要的化工原料
B. 将煤干馏不能直接得到纯净的苯
C. 制聚苯乙烯的反应①为加成反应,反应②为消去反应
D. 反应①②③的原子利用率都达到了100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
②N2(g)+O2(g) ![]() 2NO(g) △H2
2NO(g) △H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下
③NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
下列说法不正确的是
A. 反应③一定能自发进行
B. 反应②生成物总能量高于反应物总能量
C. 反应①使用催化剂,反应速率加快,△H1减小
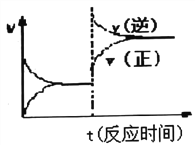
D. 反应③达到平衡后改变条件,v(正)、v(逆)的变化如图所示,则该条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
选项 | 酸 | 碱 | 碱性氧化物 | 盐 |
A | H2CO3 | 纯碱 | CaO | 明矾 |
B | H2SO4 | 烧碱 | Na2O | 小苏打 |
C | HNO3 | 氨水 | Al2O3 | 石灰石 |
D | NaHCO3 | 熟石灰 | Al(OH)3 | 食盐 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硝酸和浓硫酸的叙述中,正确的是( )
A.露置于空气中,容器内酸液的质量都减轻
B.常温下都能用铝制容器贮存
C.露置于空气中,容器内酸液的浓度都增大
D.常温下都能与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的很多化合物有重要的作用。
(1)羰基硫(COS)可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐。则生两种硫酸氢盐的化学式分别是________ 、__________。
(2)氧硫化碳水解及部分应用流程如图所示(部分产物已略去)
![]()
①已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为________________。
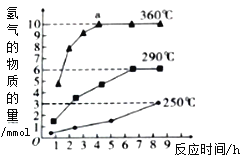
②如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mol)。由图象分析可知,a点时M溶液中除S2O32-外,还一定含有_______(填含硫微粒的离子符号)
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式_________________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1的H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
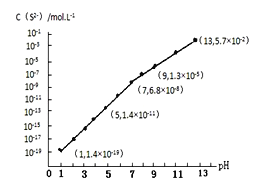
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol.L-Mn2+、0.10 mol.L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。
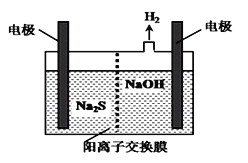
电解过程中阳极区发生如下反应:
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:_____________。
②Na2S溶液中离子浓度由大到小顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
Y | Y的一种核素质量数为24.中子数为12 |
Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com