
【题目】离子Rn-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目为( )
A.A-n-xB.A-n+xC.A+n+xD.A+n-x
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O与CO2互为等电子体.下列关于N2O的说法正确的是( )
A. N2O的空间构型与CO2构型不同
B. N2O的空间构型与H2O构型相似
C. N2O的空间构型与NH3构型相似
D. N2O的空间构型为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分为K2SO4·A12(SO4)3·2A12O3·6H2O此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下
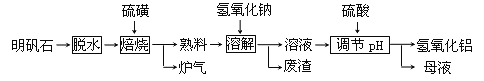
(1)可看成是硫酸铝和单质硫反应,生成氧化铝和一种气体,写该反应的化学方程式为__________________________________________。
(2)分离溶液和废渣的操作需要用到的玻璃仪器有:____________________________________,溶解时反应的离子方程式为________________________________。
(3)“调节pH”后过滤、洗涤A1(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是______________________________________________。
(4)母液中可回收的物质是_____________________________。
(5)若“焙烧”过程中恰好消耗32g硫黄;则理论上最终可得到_____g氢氧化铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以C8H18为原料经裂解制得乙烯,进而制得1,2-二溴乙烷,根据如图所示装置,结合有关知识回答问题:
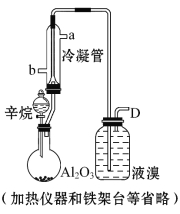
(1)生成乙烯的化学方程式为 , 。
(2)生成1,2-二溴乙烷的化学方程式是 。
(3)使用冷凝管的目的是 ,
冷凝管的进、出水方向为 。
(4)设计三种简单的实验证明广口瓶内发生的是加成反应而不是取代反应:
①第一种: 。
②第二种: 。
③第三种: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)试分析下列各种情况下微粒间作用力的变化情况,用“离子键”“极性键”或“非极性键”填空:
①NaCl溶于水时被破坏的是 。
②HCl溶于水时被破坏的是 。
③Na2O熔化时被破坏的是 。
④NaOH和HCl反应时形成 和 。
⑤反应2H2+O2![]() 2H2O中,被破坏的是 ,形成的是 。
2H2O中,被破坏的是 ,形成的是 。
⑥Ca(OH)2和NH4Cl反应时,被破坏的化学键有 ,形成的化学键有 。
(2)下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的反应是 (填字母)。
A.NH4Cl=NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温恒压的密闭容器中发生如下反应:M(g)+N(g)![]() 2R(g)△H<0,t1时刻达到平衡,在t2时刻改变某一条件,其反应过程如下图所示。下列说法不正确的是
2R(g)△H<0,t1时刻达到平衡,在t2时刻改变某一条件,其反应过程如下图所示。下列说法不正确的是
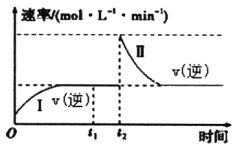
A. t1时刻的v(正)小于t2时刻的v(正)
B. t2时刻改变的条件是向密闭容器中加R
C. I、Ⅱ两过程达到平衡时,M的体积分数相等
D. I、Ⅱ两过程达到平衡时,反应的平衡常数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com