
【题目】在一恒温恒压的密闭容器中发生如下反应:M(g)+N(g)![]() 2R(g)△H<0,t1时刻达到平衡,在t2时刻改变某一条件,其反应过程如下图所示。下列说法不正确的是
2R(g)△H<0,t1时刻达到平衡,在t2时刻改变某一条件,其反应过程如下图所示。下列说法不正确的是
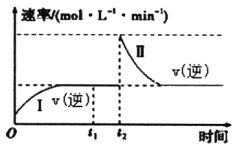
A. t1时刻的v(正)小于t2时刻的v(正)
B. t2时刻改变的条件是向密闭容器中加R
C. I、Ⅱ两过程达到平衡时,M的体积分数相等
D. I、Ⅱ两过程达到平衡时,反应的平衡常数相等
【答案】A
【解析】试题分析:已知反应M(g)+N(g)![]() 2R(g)△H<0,在一恒温恒压的密闭容器中发生,t1时刻达到平衡,在t2时刻改变某一条件,由图可知,反应再次达到平衡后,逆反应速率与原平衡相同,由此可知,改变的条件一定是加入了一定量的R而增大了R的浓度,由于容器为恒温恒压的,故容器体积必然成比例增大,所以在t2时刻反应物的浓度都减小。A. t1时刻的v(正)大于t2时刻的v(正),A不正确;B. t2时刻改变的条件是向密闭容器中加R,B正确;C. I、Ⅱ两过程达到平衡时,两平衡等效,所以M的体积分数相等,C正确;D. 因为温度相同,所以I、Ⅱ两过程达到平衡时,反应的平衡常数相等,D正确。本题选A。
2R(g)△H<0,在一恒温恒压的密闭容器中发生,t1时刻达到平衡,在t2时刻改变某一条件,由图可知,反应再次达到平衡后,逆反应速率与原平衡相同,由此可知,改变的条件一定是加入了一定量的R而增大了R的浓度,由于容器为恒温恒压的,故容器体积必然成比例增大,所以在t2时刻反应物的浓度都减小。A. t1时刻的v(正)大于t2时刻的v(正),A不正确;B. t2时刻改变的条件是向密闭容器中加R,B正确;C. I、Ⅱ两过程达到平衡时,两平衡等效,所以M的体积分数相等,C正确;D. 因为温度相同,所以I、Ⅱ两过程达到平衡时,反应的平衡常数相等,D正确。本题选A。


科目:高中化学 来源: 题型:
【题目】硫的很多化合物有重要的作用。
(1)羰基硫(COS)可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐。则生两种硫酸氢盐的化学式分别是________ 、__________。
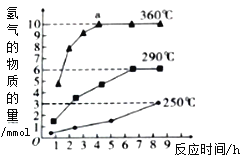
(2)氧硫化碳水解及部分应用流程如图所示(部分产物已略去)
![]()
①已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为________________。
②如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mol)。由图象分析可知,a点时M溶液中除S2O32-外,还一定含有_______(填含硫微粒的离子符号)
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式_________________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1的H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
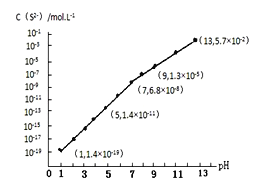
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol.L-Mn2+、0.10 mol.L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。
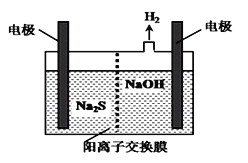
电解过程中阳极区发生如下反应:
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:_____________。
②Na2S溶液中离子浓度由大到小顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者相符的是( )
选项 | A | B | C | D |
实 验 |
|
|
|
|
实 验 现 象 | 打开汽水瓶盖时,汽水 会自动喷出来 | 碘溶于水,几乎不溶于 汽油 | 白磷燃烧,产生大量白烟,活塞先向右再向左移,冷却至室温后,最终停在刻度“4”附近 | 空气中,带火星的木条复燃;呼出气体中,带火星的木条熄灭 |
实 验 结 论 | 说明气体在水中的溶解度随压强的增大而减小 | 说明物质的溶解性与溶剂的种类有关 | 氧气约占空气体积的五分之一 | 空气中的氧气比呼出气体中氧气多 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列八种物质①丙烯、②甲苯、③聚氯乙烯、④聚异戊二烯、⑤丙炔、⑥环己烷、⑦环己烯、⑧溴乙烷中既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是
A. ①③④⑤⑦ B. ④⑤⑦ C. ④⑤ D. ①④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.元素周期表有7个周期,8个主族
B.零族原子的最外层电子数均为8
C.同一主族元素,最外层电子数一定相同
D.短周期是指第1、2、3、4周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
Y | Y的一种核素质量数为24.中子数为12 |
Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A. 定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO![]() 时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)基态碳原子核外电子有__种空间运动状态,其价电子排布图为__.
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为__,其碳原子杂化轨道类型为_____杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?。 ______________
(4)碳的一种同素异形体﹣﹣C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:![]() 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间八面体空隙中.则该复合型分子晶体的组成用二者的分子式可表示为__。

(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为__个.已知石墨的密度为ρg·cm﹣3,C﹣C键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__cm.
(6)金刚石和石墨的物理性质差异很大,其中:熔点较高的是___________,试从结构分析___________;硬度大的是___________,其结构原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com