
����Ŀ����̼���(��Ҫ�ɷ�ΪCeFCO3)����ȡϡ�������ұ�������Ҫ����ԭ�ϣ�������ͼ�Է�̼���Ϊԭ����ȡ��Ĺ�������ͼ���ش����⣺
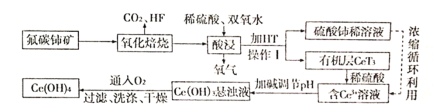
(1)CeFCO3��Ce�Ļ��ϼ�Ϊ_____����������ʱ����ʹ���մ�������ԭ����______��
(2)�������պ�IJ���֮һΪCeO2�������ʱ������Ӧ�����ӷ���ʽΪ_________��
(3)HT��һ��������ˮ���л��ܼ��������I������Ϊ________��
(4)Ϊ���������ʣ������ʵ���߷�Ӧ�¶ȣ����¶�ƫ�߽����ʷ������С����ԭ����__________��
(5)��֪�л���HT�ܽ�Ce3+��ˮ��Һ����ȡ�������ù��̿ɱ�ʾΪ��Ce3+(ˮ��)+3HT(�л���)![]() CeT3(�л���)+3H+(ˮ��)����CeT3(�л���)�м���ϡ�����ܻ�ýϴ��ĺ�Ce3+ˮ��Һ����ƽ��ǶȽ�����ԭ��________��
CeT3(�л���)+3H+(ˮ��)����CeT3(�л���)�м���ϡ�����ܻ�ýϴ��ĺ�Ce3+ˮ��Һ����ƽ��ǶȽ�����ԭ��________��
(6)д����Ce(OH)3����Һ��ͨ�������õ���ƷCe(OH)4�Ļ�ѧ����ʽ��________��
(7)298Kʱ����c(Ce3+)=0.02 mol/L����Һ�м�������������������Һ��pH������Ӧ����ҺpH=10����ʱCe3+�Ƿ������ȫ��______����Ҫ����ʽ���㣬��֪��Ksp[Ce(OH)3]=1.0��10-20��c(Ce3+)<1.0��10-5 mol/L��Ϊ������ȫ����
���𰸡�+3 �մɻ������ɵ�HF��Ӧ 2CeO2+H2O2+6H+=2Ce3++O2��+4H2O ��Һ �¶����ߣ�˫��ˮ�����ֽ⣬��ɽ�����ƫС ����Һ�м���ϡ���ᣬʹc(H+)����ƽ��������Ce3+ˮ��Һ�����ƶ� 4Ce(OH)3+O2+2H2O=4Ce(OH)4 ��
��������
��̼�����Ҫ��ѧ�ɷ�ΪCeFCO3�������̿�֪�������������ɶ�����̼��HF���弰CeO2���ټ�ϡ���ᡢ�������⣬����������ԭ��Ӧ��2CeO2+H2O2+6H+=2Ce3++O2��+4H2O����Һ�м�����ȡ��HT������IΪ��Һ����Һ�е�Ce3+��ȡ�������ټ���ϡ����ú���Ce3+����Һ��������Һ��pH�õ�Ce(OH)3�������پ���������������4Ce(OH)3+O2+2H2O=4Ce(OH)4�����ˡ�ϴ�ӡ�����ɵ�Ce(OH)4��Ʒ���Դ������
(1)CeFCO3��CO32-������-2�ۣ�F��-1�ۣ����ݻ����������������ϼ۴�����Ϊ0����֪Ce�ļ�̬Ϊ+3�ۣ���������ʱ����ʹ���մ����������������մ������к���SiO2��SiO2��HF������Ӧ��SiO2+4HF=SiF4��+2H2O������ڸ�������������ʱ����ʹ���մ�������
(2)�������պ�IJ���֮һΪCeO2�����ʱ��CeO2�����ᡢH2O2����������ԭ��Ӧ������Ce2(SO4)3��O2��H2O���÷�Ӧ�����ӷ���ʽΪ2CeO2+H2O2+6H+=2Ce3++O2��+4H2O��
(3)����I�ǵõ���Һ���л��࣬�Ƿ��뻥�����ݵ�����Һ�����ʣ���˲���I������Ϊ��Һ��
(4)���ʱ����H2O2��H2O2���ȶ����ڸ����»ᷢ���ֽ⣬��ɽ�����ƫС��
(5)�ù����д���Ce3+(ˮ��)+3HT(�л���)![]() CeT3(�л���)+3H+(ˮ��)������Һ�м���ϡ���ᣬʹ��Һ��c(H+)����ѧƽ�������ƶ�����������Ce3+ˮ��Һ�ķ����ƶ����Ӷ��ܻ�ýϴ��ĺ�Ce3+ˮ��Һ��
CeT3(�л���)+3H+(ˮ��)������Һ�м���ϡ���ᣬʹ��Һ��c(H+)����ѧƽ�������ƶ�����������Ce3+ˮ��Һ�ķ����ƶ����Ӷ��ܻ�ýϴ��ĺ�Ce3+ˮ��Һ��
(6)��Ce(OH)3����Һ��ͨ������������������ԭ��Ӧ�õ���ƷCe(OH)4���÷�Ӧ�Ļ�ѧ����ʽΪ��4Ce(OH)3+O2+2H2O=4Ce(OH)4��
(7)298Kʱ����c(Ce3+)=0.02 mol/L����Һ�м���NaOH��Һ��������Һ��pH������Ӧ����ҺpH=10����c(OH-)=1.0��10-4 mol/L�� Ce3+���γɳ�����c(Ce3+)��c3(OH-)>Ksp[Ce(OH)3]������ʱ��Һ��c(Ce3+)= mol/L=1.0��10-8 mol/L<1.0��10-5 mol/L�����Ce3+������ȫ��
mol/L=1.0��10-8 mol/L<1.0��10-5 mol/L�����Ce3+������ȫ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������[BrCH2CH2Br��������Ϊ��ɫҺ�壬������ˮ���ܶȱ�ˮ���۵�9�棬�е�132��]������Ѭ���������ܼ�����������ԭ������ʵ������ȡ��2C2H5OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br��
BrCH2CH2Br��
��֪��140��ʱ��������Ӧ��������(C2H5OC2H5)���ֲ����Ȼ�����SO2��CO2��
ʵ�鲽�����£�
�ٰ���ͼ��װ�������г�װ���ԣ�����������Ժ������Լ���
���ڱ�ˮԡ��ȴ�������£���20mLŨ���Ỻ���ӵ�10mL95%�Ҵ��У�ȡ��5mL���Һ����������ƿ�У���ʣ�ಿ�������ѹ��Һ©����
�ۼ���A��175�棬��ѹ��Һ©�������������μӻ��Һ��D��Һ�巴Ӧ��ȫ��
�ܽ�D�в����Ƶ���Һ©����������ˮ��NaOH��Һ��ˮϴ�Ӳ���Һ�����л����������MgSO4���壬���ˡ�����Y���ռ���BrCH2CH2Br4.23g��
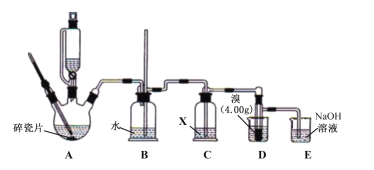
��ش��������⣺
��1��B�г����ܵ�������___��
��2���Լ�X��ѡ��___������ţ���
a.NaOH��Һ b.����NaHSO3��Һ c.���Ը��������Һ d.Ũ����
��3��D�о�֧�Թܻ����������ˮ��Ŀ����___����Ӧ������������ˮ��ȴ��֧�Թܣ�������ˮ���ɱ�ˮ������ǿ��ȴЧ��������Ҫȱ����___��
��4����������ƻ��Һʹ�õIJ�������������Ͳ������___��
��5����ֱ�ӽ�ȫ�����Һ���ȵ�170����ȣ����������175���������Һ�������μӻ��Һ������Ҫ���ŵ���___��
��6����Ӧ������E����Һ��BrO3-����E�з�����Ӧ�����ӷ���ʽΪ___��
��7������ܲ���YΪ___��
��8��BrCH2CH2Br�IJ���Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Mg2+��NH4+��Al3+�����Һ�м���Na2O2���������ɳ�������������������꣩�Ĺ�ϵ��ͼ��ʾ������Һ��Mg2+��NH4+��Al3+�������ӵ����ʵ���֮��Ϊ�� ��
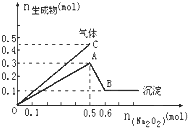
A.1��1��2B.2��2��1C.1��2��2D.9��2��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������ķ�Ӧ����������������Ի�������Ⱦ������Ҫ���塣
��1�������¶ȣ���������Ļ�ѧ��Ӧ����������![]() �ķ�Ӧ����ȴ�����¶ȵ����߶���С���������ϵ�֪���÷�Ӧ���̷�Ϊ����������
�ķ�Ӧ����ȴ�����¶ȵ����߶���С���������ϵ�֪���÷�Ӧ���̷�Ϊ����������
��![]() ���죩
���죩 ![]()
![]() ��
��![]() ��
��![]()
![]() ��
��![]() ��
��![]()
��![]() ������
������ ![]()
![]() ��
��![]() ��
��![]()
![]() ��
��![]() ��
��![]()
�ش�
�ٷ�Ӧ![]() ��
��![]() ____���ú�
____���ú�![]() ��
��![]() ��ʽ�ӱ�ʾ����һ���¶��£���Ӧ
��ʽ�ӱ�ʾ����һ���¶��£���Ӧ![]() �ﵽƽ��״̬��д����
�ﵽƽ��״̬��д����![]() ����
����![]() ����
����![]() ����
����![]() ����ʾ��ƽ�ⳣ������ʽ
����ʾ��ƽ�ⳣ������ʽ![]() ____��
____��
�ھ���![]() ��Ӧ���ʵ��Ƿ�Ӧ����Ӧ��Ļ��
��Ӧ���ʵ��Ƿ�Ӧ����Ӧ��Ļ��![]() �뷴Ӧ��Ļ��
�뷴Ӧ��Ļ��![]() �Ĵ�С��ϵΪ
�Ĵ�С��ϵΪ![]() ____
____![]() ������
������![]() ����
����![]() ������
������![]() ������
������
��2���������ȣ�![]() �����л��ϳ�����Ҫ���Լ�����
�����л��ϳ�����Ҫ���Լ�����![]() ��
��![]() ��һ�������ºϳɡ���
��һ�������ºϳɡ���![]() �������������£������ʵ���֮��Ϊ
�������������£������ʵ���֮��Ϊ![]() ��
��![]() ��
��![]() �Բ�ͬ�ĵ��ȱȽ������·�Ӧ��
�Բ�ͬ�ĵ��ȱȽ������·�Ӧ��![]()
![]() ��ƽ��ʱij��Ӧ���ת�����뵪�ȱȼ���ͬ�¶ȵĹ�ϵ�������ͼ��
��ƽ��ʱij��Ӧ���ת�����뵪�ȱȼ���ͬ�¶ȵĹ�ϵ�������ͼ��
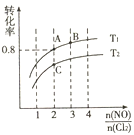
���ж�ͼ���¶�![]() ��
��![]() �Ĺ�ϵ��
�Ĺ�ϵ��![]() ____
____![]() ��������
��������![]() ������
������![]() ������
������![]() ����
����
��ͼ��������Ϊ����____���ѧʽ����ת���ʣ�������_____��
��ͼ��![]() ��
��![]() ��
��![]() ������ƽ��ʱ
������ƽ��ʱ![]() �������������____��������
�������������____��������![]() ������
������![]() ������
������![]() ����
����
��![]() �¶��£��÷�Ӧ��ƽ�ⳣ��
�¶��£��÷�Ӧ��ƽ�ⳣ��![]() ____��
____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�����ֱ����Ũ�ȵ�����Ĺ���ϡ���ᷴӦ��������������(V)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ�������й��ڷ�Ӧ��þ������������ȷ����

A. �������ʵ���֮��Ϊ3��2
B. ��������֮��Ϊ3��2
C. ����Ħ������֮��Ϊ2��3
D. ��������H2SO4�����ʵ���֮��Ϊ2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mLϡH2SO4��ϡHNO3�Ļ����Һ���������ۣ�����������۵����������������������״����֮��Ĺ�ϵ��ͼ��ʾ����ÿһ��ֻ��Ӧһ����Ӧ������˵����ȷ���ǣ� ��
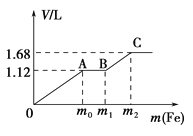
A. ��ʼʱ����������ΪH2
B. AB�η����ķ�ӦΪ�û���Ӧ
C. �μӷ�Ӧ���۵�������m2=5.6 g
D. ���û����Һ��c��HNO3��=0.5 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժһ�����о��ɹ�ʵ���˼����Ч������ϩ���䷴ӦΪ��2CH4(g)![]() C2H4(g)+2H2(g) ��H��0
C2H4(g)+2H2(g) ��H��0
���� | ȼ����(kJ/mol) |
���� | 285.8 |
���� | 890.3 |
��ϩ | 1411.5 |
(1)��֪������ʵ�ȼ�������������Ȼ�ѧ����ʽ��2CH4(g)![]() C2H4(g)+2H2(g) ��H=__��
C2H4(g)+2H2(g) ��H=__��
(2)�¶�ΪT1��ʱ����1 L�ĺ��ݷ�Ӧ���г���2 mol CH4��������������Ӧ����Ӧ0��15 min CH4�����ʵ�����ʱ��仯��ͼ1��ʵ����10��15 minʱH2��Ũ��Ϊ1.6 mol/L��

����ͼ1������a��b�ֱ��ʾ��T1��ʱ��ʹ�õ����������ֲ�ͬ�Ĵ���ʱ���ﵽƽ�������n(CH4)�仯���ߣ��жϣ�����a_____b������ڡ������ڡ�����
����15 minʱ�ı䷴Ӧ����������n(CH4)�����仯(��ͼ1)����ı�����������ǣ�_____(�δ�һ������)��
(3)ʵ����v��=k��c2(CH4)��v��=k��c(C2H4)��c2(H2)������k����k��Ϊ���ʳ��������¶��йأ��¶�Ϊ![]() ʱ��k����k���ı�ֵΪ______(����ֵ)�������¶���T1���ߵ�T2����Ӧ��������ı���v��_______ v�������������=�����������жϵ�������_________��
ʱ��k����k���ı�ֵΪ______(����ֵ)�������¶���T1���ߵ�T2����Ӧ��������ı���v��_______ v�������������=�����������жϵ�������_________��
(4)������Ա����˼���ȼ�ϵ�ز����ڵ��(��ͼ2)��������Dz�����Y2O3��ZrO2�Ĺ��壬���ڸ����´���O2-��
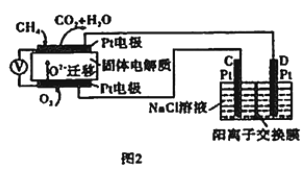
��ͼ��C����PtΪ_______(�����������)����
�ڸõ�ع���ʱ�����ĵ缫��ӦʽΪ________��
���øõ�ص�ⱥ��ʳ��ˮ��һ��ʱ����ռ�����״�������������Ϊ112 mL����������������Һ��25��ʱpH=_______��������ǰ��NaCl��Һ�������Ϊ500 mL����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̽����Ӧ���ʺͻ�ѧƽ��Ӱ�����ص��ĸ�ʵ�飬�ش��������⣺
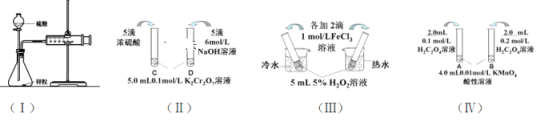
��1������ʵ�飨����̽��п��1mol/L�����4mol/L���ᷴӦ�����ʣ����Բⶨ�ռ�һ������������õ�ʱ�䡣���˷�����Ҫ���Ƶı����У�����д�������___����Ϊ�˺�����Ӧ�Ŀ����������Բ����µIJⶨ������_____��
��2��ʵ�飨������֪��Cr2O72- ����ɫ��+ H2O![]() 2CrO42-����ɫ��+ 2H+��D�Թ���ʵ������Ϊ_______________________________����ƽ���ƶ�ԭ������ԭ��_______________________
2CrO42-����ɫ��+ 2H+��D�Թ���ʵ������Ϊ_______________________________����ƽ���ƶ�ԭ������ԭ��_______________________
��3��ʵ�飨������ʵ��Ŀ����̽��____________________��
��4���������½���ʵ�飨������ʵ��Ŀ����_____������Һ��ɫ��ʱ�䣺t(A)________t(B)����>��<��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ�ֳ��õĻ��ʣ��乤ҵ����������ͼ����ش��������⡣
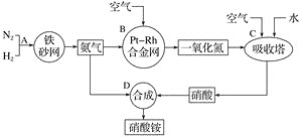
��1��д����Ӧ����B�з�����Ӧ�Ļ�ѧ����ʽ��____��
��2��������C��ͨ�������Ŀ����___��C��D������Ӧ�����з����ķ�Ӧ������������ԭ��Ӧ����___(�Ӧ��������)��
��3��Ũ����һ�㱣������ɫ�Լ�ƿ������������������û�ѧ����ʽ����ԭ��___��
��4��̼��Ũ���ᷴӦ�Ļ�ѧ����ʽ��_____��
��5����128gͭ����һ������Ũ�����в��ȡ���ͭƬ��ȫ��ʧʱ�����ռ���NO2��NO�Ļ������44.8L(��״��)��
��д�����������У��йط�Ӧ�����ӷ���ʽ��____��____��
����ɸ÷�Ӧ������Ҫ��ȡ10mol��L��1��Ũ����_____mL��
�ۻ��������NO2�����Ϊ____L��NO�����Ϊ____L(��Ϊ��״����)��
�ܽ��ռ��������������������ʢ��ˮ��ˮ���У��������л���ͨ��O2ʹ���ַ�Ӧ����Ҫʹ��Һǡ�ó�������������������Ҫ�μӷ�Ӧ��O2�����ʵ���Ϊ____mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com