
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.2 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
| A. | 0~t1 min内的平均反应速率v(H2)=$\frac{0.2}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 平衡时CO的转化率为66.67% | |
| C. | t1时刻该反应处于平衡状态 | |
| D. | t2时刻CO的浓度为0.8 mol•L-1 |
分析 A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO),再根据速率之比等于化学计量数之比计算v(H2);
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,根据转化率定义计算CO的转化率;
C、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,据此判断;
D、根据B的分析可知,t1时刻该反应处于平衡状态,所以t2时刻CO的浓度与t1时刻相同,结合表中的数据答题.
解答 解:A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,v(CO)=$\frac{\frac{0.4mol}{2L}}{t{\;}_{1}min}$=$\frac{0.2}{{t}_{1}}$mol/(L•min),速率之比等于化学计量数之比计算v(H2)=v(CO)=$\frac{0.2}{t{\;}_{1}}$mol/(L•min),故A正确;
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,故CO的转化率为$\frac{0.4mol}{1.2mol}$×100%=33.3%,故B错误;
C、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,故C正确
D、根据B的分析可知,t1时刻该反应处于平衡状态,所以t2时刻CO的浓度与t1时刻相同,结合表中的数据可知,t1时刻CO的浓度为$\frac{1}{2}×$0.8 mol•L-1=0.4 mol•L-1,所以t2时刻CO的浓度为0.4 mol•L-1,故D错误;
故选AC.
点评 本题是化学平衡问题,主要考查化学反应速率、化学平衡及平衡常数等计算,难度中等,注意D选项中的规律利用.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与4HNO3(浓)反应 | |
| B. | Cu与8HNO3(稀)反应 | |
| C. | Cu在空气加热后生成CuO,再将CuO与硝酸反应 | |
| D. | Cu在氯气加热后生成CuCl2,再将CuCl2溶于硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2C03溶液中:c(Na+)>c(C032-)>c(OH-)>c(HC03-)>c(H+) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COOH)+c(CH3C00-) | |
| C. | NaHC03溶液中:c(C032-)+c(OH-)=c(H+)+c(H2C03) | |
| D. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
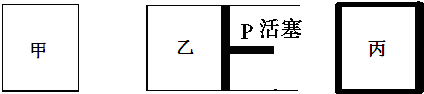
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔化状态下,能导电的物质一定是电解质 | |
| B. | 溶于水能导电的物质一定是电解质 | |
| C. | 熔化状态下,不能导电的化合物一定不是电解质 | |
| D. | BaSO4是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
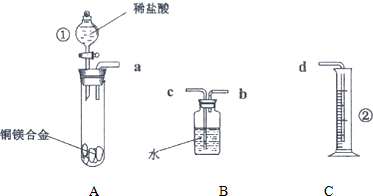
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C-CH3 | B. | 对二甲苯 | C. | 对甲乙苯 | D. | 邻甲乙苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 溶液中一定有SO42-,可能有K+、Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com