
【题目】在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6 g 。请回答下列问题:
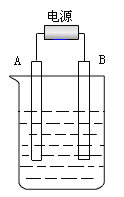
(1)A电极是接电源的______极;B电极的反应式________________________。
(2)原溶液的物质的量浓度是______mol/L,为了使溶液恢复到原浓度,应向反应后的液体中加入________;电解后溶液的pH为________。(假设电解前后溶液的体积不变)
(3)请你设计实验确定原溶液中可能所含的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论。
假设①______________________________________________
操作步骤:__________________________________________
实验现象:__________________________________________
实验结论:__________________________________________。
假设②____________________________________________
操作步骤:__________________________________________
实验现象:__________________________________________
实验结论:__________________________________________。
【答案】负 4OH- -4e- =2H2O + O2↑ 0.05 0.025molCuO或0.025molCuCO3 1 阴离子为![]() 取原溶液少量,加入盐酸,再加入BaCl2溶液 产生白色沉淀 原溶液中阴离子为
取原溶液少量,加入盐酸,再加入BaCl2溶液 产生白色沉淀 原溶液中阴离子为![]() 阴离子为
阴离子为![]() 取少量原溶液,加热蒸发浓缩,再加入铜片与适量浓硫酸 产生无色气体,且在空气中变为红棕色 原溶液中阴离子为
取少量原溶液,加热蒸发浓缩,再加入铜片与适量浓硫酸 产生无色气体,且在空气中变为红棕色 原溶液中阴离子为![]()
【解析】
(1)和电源的负极相连的是电解池的阴极发生还原反应,和电源的正极相连的是电解池的阳极发生氧化反应;
(2)阴极析出金属铜的质量是1.6g,根据电极反应计算硫酸铜的物质的量以及溶液中氢离子的物质的量,进而根据浓度等于物质的量和体积之比计算物质的量浓度以及pH,电解质的复原要求是缺什么补什么,缺多少补多少;
(3)该溶液中一定是含铜离子的可溶性的盐溶液,所以可以是硝酸铜,或是硫酸铜,根据离子的特征离子反应检验硫酸根离子以及硝酸根离子的存在即可。
(1)电解液是蓝色溶液,A电极表面有红色的固态物质生成,所以A极是铜离子得电子,所以A极是阴极,A接的是电源的负极,B电极有无色气体生成,则阳极是氢氧根失电子产生的氧气,反应:4OH--4e-=2H2O+O2↑,
故答案为:负;4OH--4e-=2H2O+O2↑;
(2)阴极反应:2Cu2++4e-=2Cu,阳极反应:4OH--4e-=2H2O+O2↑,电解时反应的总离子方程式为:2Cu2++2H2O![]() 2Cu+4H++O2↑,取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以铜离子的浓度=
2Cu+4H++O2↑,取出A电极,洗涤、干燥、称量、电极增重1.6g,所以阴极析出金属铜的质量是1.6g,即0.025mol,所以铜离子的浓度=![]() =0.05mol/L;生成0.025molCu,会生成0.0125molO2,n(Cu):n(O)=1:1,为使溶液恢复到原浓度,应向反应后的溶液中加入0.025molCuO或0.025molCuCO3;原溶液的物质的量浓度是0.05mol/L,生成氢离子的物质的量为0.05mol,所以c(H+)=
=0.05mol/L;生成0.025molCu,会生成0.0125molO2,n(Cu):n(O)=1:1,为使溶液恢复到原浓度,应向反应后的溶液中加入0.025molCuO或0.025molCuCO3;原溶液的物质的量浓度是0.05mol/L,生成氢离子的物质的量为0.05mol,所以c(H+)=![]() =0.1mol/L,即pH=1,
=0.1mol/L,即pH=1,
故答案为:0.05mol/L;0.025molCuO或0.025molCuCO3;1;
(3)该溶液中一定是含铜离子的可溶性的盐溶液,所以可以是硝酸铜,或是硫酸铜,不能是氯化铜,因为不会出现氯气,
假设①:阴离子为![]() ;检验硫酸根离子可以采用加入氯化钡溶液的方法,若有白色沉淀生成,则原溶液中所含的阴离子是
;检验硫酸根离子可以采用加入氯化钡溶液的方法,若有白色沉淀生成,则原溶液中所含的阴离子是![]() ;
;
假设②:阴离子为![]() ;检验酸环境下的硝酸根离子,可以加入金属铜并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子
;检验酸环境下的硝酸根离子,可以加入金属铜并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子![]() ;
;
故答案为:阴离子为![]() ;取原溶液少量,加入盐酸,再加入BaCl2溶液;产生白色沉淀;原溶液中阴离子为
;取原溶液少量,加入盐酸,再加入BaCl2溶液;产生白色沉淀;原溶液中阴离子为![]() ;阴离子为
;阴离子为![]() ;取少量原溶液,加热蒸发浓缩,再加入铜片与适量浓硫酸;产生无色气体,且在空气中变为红棕色;原溶液中阴离子为
;取少量原溶液,加热蒸发浓缩,再加入铜片与适量浓硫酸;产生无色气体,且在空气中变为红棕色;原溶液中阴离子为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲苯分子中所有原子在同一平面上
B. 苯、乙酸、乙醇均能发生取代反应
C. 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)
D. 可用溴的四氯化碳溶液区别![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________、________。
(2)写出Na2SO3固体氧化变质的化学方程式_____________。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________,
在过滤前,需要检验是否沉淀完全,其操作是______________。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________(填“偏高”或“偏低”)。
(5)若操作正确,则m1________m2(填“>”、“<”或“=”),原因是_______________。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________(注明表达式中所用的有关符号的含义和单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
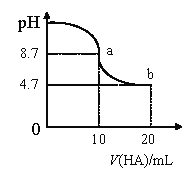
A.a点所示溶液中c(A-)+c(HA)=0.1mol/L
B.a、b两点所示溶液中水的电离程度不同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(HA)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为(C7H5NO)。
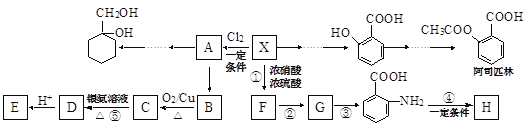
已知:![]() (苯胺,易被氧化)
(苯胺,易被氧化)
完成下列填空:
(1)X的结构简式是______,反应⑤的类型是_________。
(2)反应②③两步能否互换_______(填“能”或“不能”),理由是______。
(3)反应④的化学方程式是____________。
(4)检验B是否完全转化为C的方法是______(选填编号)。
a.定量测熔点 b.定性酸性高锰酸钾溶液
c.定量银氨溶液 d.定性新制氢氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图分别表示红磷、白磷燃烧时的能量变化,有关说法正确的是( )
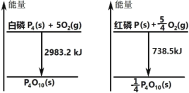
A.白磷比红磷稳定
B.白磷燃烧产物比红磷燃烧产物稳定
C.1mol 白磷转变为红磷放出 2244.7kJ 的热量
D.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物X、Y、Z的名称和结构简式如下表,下列说法不正确的是
X | Y | Z | |
名称 | 3-甲氧基-4-羟基扁桃酸 | 没食子酸乙酯 | 丁香酸 |
结构简式 |
|
|
|
A.X、Y、Z都能与NaOH溶液反应
B.X、Y互为同分异构体,X、Z互为同系物
C.依据X的名称,可推测出Z的名称为3,5-二甲氧基-4-羟基苯甲酸
D.推测出没食子酸的分子式为C7H6O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20mL浓度均为0.1mol/L的NaOH和MOH溶液中分别滴加0. 1mol/L盐酸,溶液的pH随盐酸体积变化如图所示。下列说法不正确的是( )
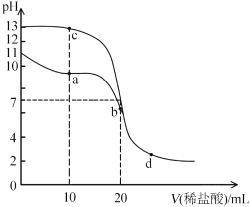
A.MOH的电离常数约为1×l0-5B.a点溶液中存在![]()
C.b点和c点溶液混合后显碱性D.水的电离程度:d>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com