
| A、反应容器中压强不随时间变化 |
| B、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
| C、SO2与SO3的浓度相等 |
| D、容器中SO2、O2、SO3共存 |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、7.42g | B、5.3g |
| C、6.36g | D、8.48g |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、四种毒品中都含有苯环,都属于芳香烃 |
| B、摇头丸经过消去反应、加成反应可制取冰毒 |
| C、用酸性高锰酸钾溶液可以鉴别大麻和摇头丸 |
| D、氯胺酮分子中环上所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁及其化合物均为重要化合物.回答下列问题
铁及其化合物均为重要化合物.回答下列问题| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/m01 | 1.0 | 1.5 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 硫酸 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g?cm-3 质量分数:98% |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体的密度不随时间而变化 |
| B、容器内的总压强不随时间而变化 |
| C、单位时间内生成2nmol AB的同时,生成nmol的B2 |
| D、A2、B2、AB的反应速率比为1:1:2的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
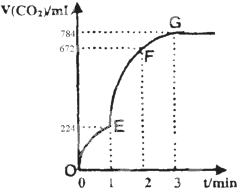 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(Ⅰ) | B、(Ⅱ) |
| C、(Ⅲ) | D、(Ⅱ)和(Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:

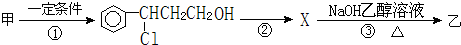
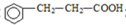 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com