
| A、7.42g | B、5.3g |
| C、6.36g | D、8.48g |
| 0.14mol |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在基态多电子的原子中,最易失去的电子能量最高电离能也最小 |
| B、锗的第一电离能高于碳而电负性低于碳 |
| C、PH3分子呈三角锥形,沸点比NH3低 |
| D、SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:16 | B、16:1 |
| C、7:17 | D、7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时刻 | 时间 | 可能采取的措施 | 体系中平衡移动的方向 |
| 3 | - | ---- | |
| - | 3~4 | ---- | |
| 5 | - | ---- | |
| - | 5~6 | ---- | |
| 7 | - | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质的质量分数为ω=
| ||
B、溶质的物质的量浓度c=
| ||
C、溶液中c (OH-)=
| ||
| D、上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 制取氯气 |
B、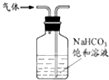 除去氯气中的少量氯化氢 |
C、 分离二氧化锰和氯化锰溶液 |
D、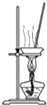 蒸干氯化锰溶液制MnCl2?4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器中压强不随时间变化 |
| B、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
| C、SO2与SO3的浓度相等 |
| D、容器中SO2、O2、SO3共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com