
| A、在基态多电子的原子中,最易失去的电子能量最高电离能也最小 |
| B、锗的第一电离能高于碳而电负性低于碳 |
| C、PH3分子呈三角锥形,沸点比NH3低 |
| D、SiF4和SO32-的中心原子均为sp3杂化 |


科目:高中化学 来源: 题型:
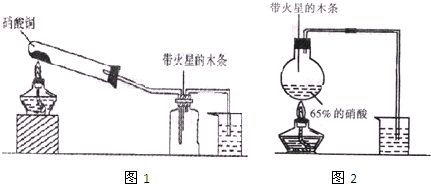
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①②③ |
| C、②③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na218O2+2H2O=4Na18OH+O2↑ |
| B、2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O |
| C、NH3?2H2O+HCl=NH4Cl+2H2O |
| D、K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.42g | B、5.3g |
| C、6.36g | D、8.48g |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Li |
| Li+ |
| Cl2 |
| Cl- |
| S |
| S2- |
| S4+ |
| S |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁及其化合物均为重要化合物.回答下列问题
铁及其化合物均为重要化合物.回答下列问题| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/m01 | 1.0 | 1.5 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com