

分析 (1)图1为原电池反应,Fe为负极,发生反应:Fe-2e-=Fe2-,石墨为正极,发生反应Cu2++2e-=Cu;
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,正极发生2H++2e-═H2↑,负极发生Fe-2e-=Fe2-,加入氯水发生2Fe2++Cl2═2Fe3++2Cl-;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,乙为电解池装置.
解答 解:(1)图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
12g n
则:n=0.2mol,
故答案为:Fe+Cu2+═Fe2++Cu;0.2;
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,发生:NH4++H2O?NH3•H2O+H+,石墨电极正极发生2H++2e-═H2↑,负极发生反应:Fe-2e-=Fe2-,加入氯水发生反应:2Fe2++Cl2═2Fe3++2Cl-;如果+3价铁被氧化为FeO42-,发生反应为:2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+,
故答案为:2H++2e-═H2↑;2Fe2++Cl2═2Fe3++2Cl-;2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,铁为负极,铜为正极,正极发生 O2+2H2O+4e-═4OH-,呈碱性,滴加酚酞,溶液变红,则乙装置铜为阳极,石墨为阴极,乙为电解池装置,阳极发生2Cl--2e-═Cl2↑,生成的氯气可用湿润淀粉碘化钾试纸检验,试纸变蓝,
故答案为:溶液变红; O2+2H2O+4e-═4OH-;阴;湿润淀粉碘化钾试纸.
点评 本题综合考查原电池和电解池知识,题目难度中等,侧重于电化学知识的综合运用的考查,注意明确电极反应方程式的书写方法,为解答该题的关键.


科目:高中化学 来源: 题型:解答题
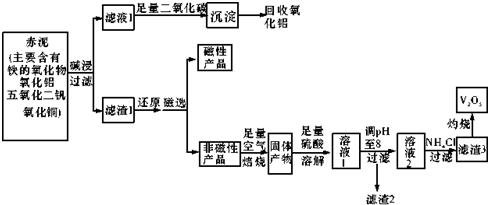
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ④③②① | C. | ①②③④ | D. | ④①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: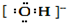 | B. | CH4分子的球棍模型: | ||
| C. | 乙烯的最简式:CH2 | D. | 氟离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-Cl | H-Br | CI-CI | Br-Br |
| 键能( KJ•mol-1) | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
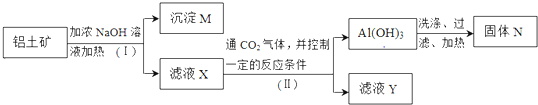
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com