
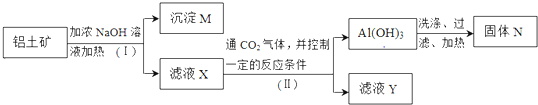
分析 铝土矿中含有A12O3、Fe2O3、SiO2等,NaOH和A12O3、SiO2反应生成可溶性盐,Fe2O3不溶于NaOH,所以M的成分主要是Fe2O3,滤液中的成分为Na2SiO3、NaAlO2,向滤液X中通入二氧化碳,并控制一定反应条件,得到Al(OH)3,滤液Y中含有碳酸氢钠、硅酸钠,Al(OH)3加热分解生成氧化铝,所以N的成分是A12O3,结合基本操作方法、物质的性质分析解答,
(1)分离不溶性固体和溶液的方法为过滤,通过以上分析知,M中除了含有泥沙外,还含有Fe2O3,固体N是Al2O3,I中含铝元素反应是氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(2)分析可知滤液X成分为Na2SiO3、NaAlO2,通足量的CO2气体,和硅酸钠反应生成白色沉淀硅酸,和偏铝酸钠溶液反应生成氢氧化铝沉淀,溶质生成碳酸氢钠溶液;
(3)氢氧化铝属于两性化合物,能溶于强酸和强碱,但不能溶于弱碱,所以用氯化铝溶液和氨水制取反应生成氢氧化铝和氯化铵;
(4)沉淀的质量为最大值的一半时,对应的氢氧化钠的体积有两个,一个是氢氧化钠不足量生成0.39g沉淀所用的体积,一个是有部分沉淀溶解所需氢氧化钠的体积,依据化学方程式定量关系计算.
解答 解:铝土矿中含有A12O3、Fe2O3、SiO2等,NaOH和A12O3、SiO2反应生成可溶性盐,Fe2O3不溶于NaOH,所以M的成分主要是Fe2O3,滤液中的成分为Na2SiO3、NaAlO2,向滤液X中通入二氧化碳,并控制一定反应条件,得到Al(OH)3,滤液Y中含有碳酸氢钠、硅酸钠,Al(OH)3加热分解生成氧化铝,所以N的成分是A12O3,
(1)分离不溶性固体和溶液的方法为过滤,所以Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是;过滤,通过以上分析知,M中除了含有泥沙外,还含有Fe2O3,固体N是Al2O3,I中含铝元素反应是氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为:A12O3+2NaOH=2NaAlO2+H2O
故答案为:过滤;Fe2O3;A12O3+2NaOH=2NaAlO2+H2O;
(2)若向滤液X成分为Na2SiO3、NaAlO2,通足量的CO2气体,和硅酸钠反应生成白色沉淀硅酸,和偏铝酸钠溶液反应生成氢氧化铝沉淀,溶质生成碳酸氢钠溶液,则滤液Y中含碳元素的溶质为NaHCO3,滤液X生成Al(OH)3的反应离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:NaHCO3;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)氢氧化铝属于两性化合物,能溶于强酸和强碱,但不能溶于弱碱,所以用氯化铝溶液和氨水制取氢氧化铝,反应方程式为:AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,反应的离子方程式为:Al3++3NH3.H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3.H2O═Al(OH)3↓+3NH4+;
(4)当沉淀的质量为最大值的一半时,对应的氢氧化钠的体积有两个,一个是氢氧化钠不足量生成0.39g沉淀所用的体积,一个是有部分沉淀溶解所需氢氧化钠的体积.
①氯化铝过量生成沉淀所用氢氧化钠的体积:
设生成0.39g沉淀需氢氧化钠的体积为xL.
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3mol 78g
2mol/L×xL 0.39g
x=0.0075
所以氢氧化钠的体积为7.5mL;
②部分沉淀溶解所需氢氧化钠的体积
设生成0.78g沉淀所需氢氧化钠的体积为yL;
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3mol 78g
2mol/L×yL 0.78g
y=0.015L=15mL;
设生成的0.78g沉淀有0.39g溶解所需氢氧化钠的体积为zL.
Al(OH)3+NaOH=NaAlO2+2H2O
78g 1mol
0.39g 2mol/L×z L
z=0.0025L=2.5mL
所以当生成的沉淀又有0.39g 溶解时所用的氢氧化钠的体积为 15mL+2.5mL=17.5 mL
故答案为:7.5 或17.5.
点评 本题以铝为载体考查了工艺流程、分析问题的能力、计算能力等,明确NaOH溶液逐滴加入到AlCl3溶液中的反应情况.明确物质的性质是解本题关键,根据物质间的反应来分析解答,会从整体上分析问题,并迁移基础知识解答,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴随有能量变化的物质变化都是化学变化 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H1,反应2SO2(s)+O2(g)?2SO3(g)△H2,则△H1>△H2 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A(g)的能量一定高于C(g)的能量 | |
| B. | 该反应不需要加热 | |
| C. | 1 mol A(g)和2 mol B(g)的总能量高于1 mol C(g)的能量 | |
| D. | 该反应表示:1 mol A(g)和2 mol B(g)在一定条件下反应放出的热量为a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 12种 | C. | 10种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH${\;}_{4}^{+}$ | |
| C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔纸在酒精灯上加热,溶化后的液态铝滴落下来,金属铝的熔点较低 | |
| D. | 将AlCl3加入Ba(HCO3)2溶液中同时有气体和沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com