
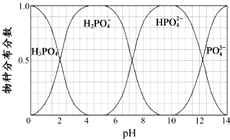
 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.分析 (1)根据为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;
(2)pH由6增大至8过程中HPO42-增多,所以是溶液中的H2PO4-和氢氧根离子发生反应;
(3)溶液中主要含磷物种浓度大小关系可由图表得出;
(4)若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性;
(5)根据图象可知,pH=12 时Na2HPO4和Na3PO4的物质的量几乎相等,结合质量守恒定律判断参加反应的H3PO4与NaOH的物质的量之比.
解答 解:(1)为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可),
故答案为:4~5.5(介于此区间内的任意值或区间均可);
(2)根据图象可知,pH从6到8的过程中H2PO4-减小、HPO42-增多,应该为H2PO4-和氢氧根离子发生反应,反应的离子方程式为:H2PO4-+OH-=HPO42-,
故答案为:H2PO4-+OH-=HPO42;
(3)溶液中主要含磷物种浓:度大小关系可由图表得出c(HPO42-)>c(H2PO4-),
故答案为:c(HPO42-)>c(H2PO4-);
(4)HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;
由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性,
故答案为:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+;
(5)几乎图象曲线变化可知,pH=12时Na2HPO4和Na3PO4的物质的量几乎相等,根据质量守恒,设Na2HPO4和Na3PO4的物质的量物质的量为n,则需要消耗H3PO42nmol,消耗NaOH的物质的量为5nmol,则参加反应的H3PO4与NaOH的物质的量之比为:2nmol:5nmol=2:5,
故答案为:2:5.
点评 本题考查离子浓度大小比较、酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,他们的浓重的,注意把握图象所给信息,为解答该题的关键.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸在反应中仅体现还原性 | |
| B. | 被氧化和被还原的物质的物质的量之比为1:1 | |
| C. | 每生成0.1molClO2转移0.2mol电子 | |
| D. | 氧化性:NaClO3<Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 CCl4中含有0.4NA个碳氯单键 | |
| B. | 22.4LCl2通入水中充分反应,共转移NA个电子 | |
| C. | 1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA | |
| D. | 5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.海水蒸馏得到淡水 | B.中和滴定 | C.苯萃取碘水中I2,分出水层后的操作 | D.制备乙酸乙酯 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com