
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:填空题
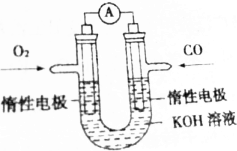 某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)
某实验小组将反应2CO(g)+O2(g)═2CO2(g)设计成如图所示的电池装置,负极的电极反应式为CO-2e-+2OH-=CO32-+H2O;正极的电极反应式为O2+2H2O+4e-=4OH-.电池工作时,正极区域溶液的pH变大(填“变大”“变小”或“不变”)用该原电池做电源,电解200mL饱和食盐水(足量),消耗的标准状况下的CO224mL,则溶液的pH=13.(不考虑溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 硅在电子工业中,是重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
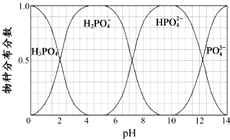 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②⑤ | C. | ①③⑤⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 用pH试纸测溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH约为1 | |
| D. | 25℃时,pH=12的氨水溶液与pH=2的盐酸等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com