

| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
| 10-4×10-4 |
| 10-2 |
| 10-4 |
| 1% |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
| A、除去NO中混有的NO2将混合气体先通过足量水,然后用CaCl2干燥 |
| B、配制一定物质的量浓度的Fe(NO3)2溶液:将一定量的Fe(NO3)2溶于适量的硝酸中,再加入水稀释至指定浓度 |
| C、向足量饱和石灰水中加入少CaO,恢复至室温后溶液pH变大 |
| D、工业上分別用电解熔融Al2O3、MgO、NaCl的方法制取Al、Mg、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
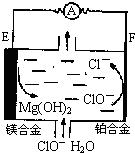 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| CuO |
| CeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电池工作时,正极反应式为O2+2H2O+4e-=4OH- |
| B、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C、试管中NaOH溶液是用来吸收电解时产生的Cl2 |
| D、当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.021mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.| 第一电离能 | 键的极性 | 熔点 | 稳定性 |
| N | H-S键 | 金刚石 | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200mL1molAl2(SO4)3溶液中,Al3+和SO42-离子数的总和为NA |
| B、标准状况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D、0.1molO2和O3的混合气体中含氧原子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若单位时间内生成xmolSO3 的同时,消耗xmolSO2,则反应达到平衡状态 |
| B、达到化学平衡状态,2v正(O2)=v逆(SO3 ) |
| C、平衡时,SO2的浓度必定等于O2 浓度的2倍 |
| D、达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com