
分析 (1)①碳酸钙与盐酸反应生成氯化钙和二氧化碳、水;
②硫酸铜与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠;
③钠与水反应生成氢氧化钠和氢气;
(2)硫酸与碳酸钠反应生成硫酸钠和水、二氧化碳;
(3)①Ca2++CO32-═CaCO3↓可以表示可溶性钙盐与可溶性碳酸盐反应生成碳酸钙沉淀和水;
②OH-+HCO3-═CO32-+H2O表示可溶性强碱与可溶性碳酸盐反应生成可溶性碳酸盐和水.
解答 解:(1)①碳酸钙与盐酸反应生成氯化钙和二氧化碳、水,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+;
故答案为:CaCO3+2H+=CO2↑+H2O+Ca2+;
②硫酸铜与氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,离子方程式:Cu 2++2OH-=Cu(OH)2↓;
故答案为:Cu 2++2OH-=Cu(OH)2↓;
③钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(2)硫酸与碳酸钠反应生成硫酸钠和水、二氧化碳,离子方程式:CO32-+2H+=CO2↑+H2O;所以可以加入适量的稀硫酸除去硫酸钠中的碳酸钠;
故答案为:硫酸;CO32-+2H+=CO2↑+H2O;
(3)①Ca2++CO32-═CaCO3↓可以表示氯化钙与碳酸钠反应,方程式:CaCl2+Na2CO3=CaCO3+2NaCl,故答案为:CaCl2+Na2CO3=CaCO3+2NaCl;
②OH-+HCO3-═CO32-+H2O可表示氢氧化钠与碳酸氢钠反应,方程式为:NaOH+NaHCO3═Na2CO3+H2O,故答案为:NaOH+NaHCO3═Na2CO3+H2O.
点评 本题考查了离子方程式的书写、物质的分离与提纯,明确反应实质及除杂原则是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol CCl4的体积约为22.4L | |
| B. | NaOH的摩尔质量是40g | |
| C. | 常温常压下,11.2L氧气与足量铜粉充分反应,转移的电子数为2NA | |
| D. | 46g NO2 和46g N2O4 含有的原子数均为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
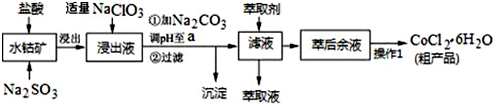
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
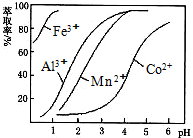
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
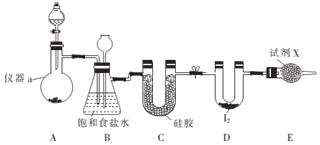
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
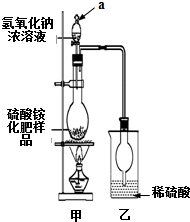 硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:
硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外 观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com