
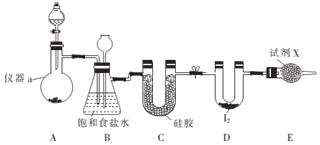
分析 实验室可用如图装置制取ICl3:装置A是Ca(ClO)2)和浓盐酸反应制取氯气,盐酸易挥发,反应制取的氯气中含有氯化氢、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据B中内外液面高低变化,可以判断是否发生堵塞,同时利用饱和食盐水除去氯气中的氯化氢,装置C是利用硅胶吸收水蒸气,装置D碘和氯气反应生成ICl3,氯气有毒需进行尾气处理,E装置吸收多余的氯气,防止污染空气.
(1)根据装置图可知仪器a的名称;
(2)次氯酸钙具有强的氧化性,能够氧化盐酸,生成氯化钙、氯气和水,依据化合价升级数目相同配平方程式;
(3)装置B作安全瓶,监测实验进行时C中是否发生堵塞,C发生堵塞时,B中压强增大,吸滤瓶中液面下降,长颈漏斗中液面上升;
(4)氯气有毒需进行尾气处理,可以用碱石灰吸收;
(5)水浴的温度不超过100℃,水浴能简便控制加热的温度,且能使受热容器受热均匀;
解答 解:(1)根据装置图可知仪器a的名称为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(2)漂白粉固体和浓盐酸反应生成氯化钙、氯气和水,化学方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(3)装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,吸滤瓶中液面下降,长颈漏斗中液面上升,
故答案为:吸滤瓶中液面下降,长颈漏斗中液面上升;
(4)反应后剩余的氯气能够污染空气,不能排放到空气中,装置E为球形干燥管,装有固体药品碱石灰,吸收多余的氯气,防止污染空气,所以试剂X为碱石灰,
故答案为:碱石灰;(5)因水浴能简便控制加热的温度,且能使受热反应试管受热均匀,由于氯气与单质碘需在温度稍低于70℃下反应,应采取水浴加热,
故答案为:水浴加热.
点评 本题考查性质实验方案的制备,为高频考点,把握氯气的性质、制法、装置的作用为解答的关键,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
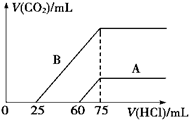 (1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
(1)取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前必须检查容量瓶是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 称好的固体试样需用纸条小心地送入容量瓶中 | |
| D. | 摇匀后发现凹液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
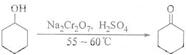
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
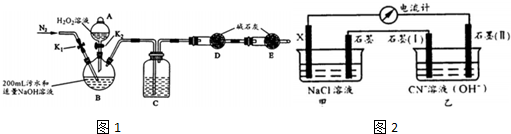
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | 关闭K2,用注射器穿过B装置的胶塞注入 稀H2S04溶液 |
| 步骤3 | 打开K1,通入N2 |
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com