
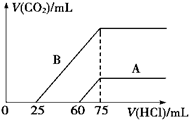
 ��1��ȡ�����ʵ���Ũ�ȵ�NaOH��Һ����A��B��ÿ��10mL���ֱ���A��B��ͨ�벻������CO2���ټ���������Һ����μ���0.1mol/L�����ᣬ��״���²�����CO2������������������֮��Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��1��ȡ�����ʵ���Ũ�ȵ�NaOH��Һ����A��B��ÿ��10mL���ֱ���A��B��ͨ�벻������CO2���ټ���������Һ����μ���0.1mol/L�����ᣬ��״���²�����CO2������������������֮��Ĺ�ϵ��ͼ��ʾ���Իش��������⣺| ʵ��� | ʵ��� | ʵ��� | |
| ȡ��ƿ��Һ���� | 400mL | 120mL | 120mL |
| ȡ��ƿ��Һ���� | 120mL | 440mL | 400mL |
| ���ɳ������� | 1.56g | 1.56g | 3.12g |
���� ��1������������������Һ��ͨ�������̼������ͨ�������̼������������Һ�еμ����ᣬ��������̼������ȫ�ų�ʱ����Һ���������Ȼ��ƣ��÷�Ӧ��ʵ����������������Ʒ�Ӧ�����Ȼ��ƣ�������������ʵ��������������Ƶ����ʵ���Ũ�ȣ�
�ڵ�����CO2����ʱ��������ӦHCO3-+H+=H2O+CO2��������A��Һ��˵���μ�����60mLʱû���������ɣ����ܷ���OH-+H+=H2O��CO32-+H+=HCO3-�������������������Դ�Сȷ��������Һ�е����ʣ�
����ȷ��B��Һ�е����ʣ��ٸ���̼�����ƺ�����ķ�Ӧ����ʽ�������ɶ�����̼�������
��2���Ȼ�������NaOH��Һ�У���ʼ�������ƹ�������ʼ������Ӧ��AlCl3+4NaOH�TNaAlO2+3NaCl+2H2O��Ȼ������Ӧ��3NaAlO2+AlCl3+6H2O=4Al��OH��3��+3NaCl��
����������Һ����AlCl3��Һ�У���ʼ������Ӧ��AlCl3+3NaOH�TAl��OH��3��+3NaCl��Ȼ������Ӧ��Al��OH��3+NaOH�TNaAlO2+2H2O��
�ɢں͢ۿ�֪��һ�����ļ����ҷ�Ӧʱ���ҵ���Խ�࣬���ɵij���Խ�٣�����ΪNaOH��Һ������ΪAlCl3��Һ��
��ʵ��٢ڿ�֪��ʵ�����NaOH���㣬AlCl3��ʣ�࣬����AlCl3+3NaOH�TAl��OH��3��+3NaCl������NaOH��Һ�����ʵ�������������NaOH��Ũ�ȣ�
��� �⣺��1���ټ���75ml����ʱ������̼����������ʱ��ҺΪ�Ȼ�����Һ�����������ӡ��������غ㣬
����n��NaOH��=n��NaCl��=n��HCl��=0.075ml��0.1mol/L=0.0075mol��
����c��NaOH��=$\frac{0.075mol}{0.01L}$=0.75mol/L��
�ʴ�Ϊ��0.75mol/L��
��CO2��NaOH��ӦΪ��CO2+NaOH=NaHCO3����CO2+2NaOH=Na2CO3+H20��
��n��CO2����n��NaOH����1����Ӧ���ٽ��У�����1ʱ��CO2��NaOHǡ�÷�Ӧ����NaHCO3������1ʱ����������NaHCO3��CO2��ʣ�ࣻ
��$\frac{1}{2}$��n��CO2����n��NaOH����1����Ӧ���٢ڽ��У�CO2��NaOH��Ӧ����ʣ�࣬������ΪNaHCO3��Na2CO3��
��n��CO2����n��NaOH����$\frac{1}{2}$����Ӧ���ڽ��У�����$\frac{1}{2}$��ʱ��CO2��NaOHǡ�÷�Ӧ����Na2CO3��С��$\frac{1}{2}$ʱ������Na2CO3��NaOH��ʣ�ࣻ
������A��֪��60ml��75mlΪ̼�����������ᷴӦ����Ӧ����ʽΪNaHCO3+HCl=NaCl+CO2��+H2O��
����n��NaHCO3��=n��HCl��=��0.075-0.06��L��0.1mol/L=1.5��10-3mol��
����Cԭ���غ㣬����n��CO2��=n��NaHCO3��=1.5��10-3mol��
�ɢٿ�֪��n��NaOH��=0.0075mol��
����n��CO2����n��NaOH��=1.5��10-3mol��0.0075mol=1��5��С��1��2�����Է�Ӧ���ڽ��У�NaOH��ʣ�࣬��Һ������ΪNa2CO3��NaOH��
����Cԭ���غ㣬����n��Na2CO3��=n��CO2��=1.5��10-3mol��
�ٸ����������غ㣬����Һ���������Ƶ����ʵ���Ϊ0.0075mol-1.5��10-3mol��2=0.0045mol��
������Һ��NaOH��Na2CO3�����ʵ���֮��Ϊ0.0045mol��1.5��10-3mol=3��1��
�ʴ�Ϊ��Na2CO3��NaOH��1��3��
��������B��֪��25ml��75mlΪ̼�����������ᷴӦ���ɶ�����̼����Ӧ����ʽΪNaHCO3+HCl=NaCl+CO2��+H2O��
����n��CO2��=n��HCl��=��0.075ml-0.025ml����0.1mol/L=0.005mol��
����CO2�������Ϊ0.005mol��22.4L/mol=0.112L=112mL��
�ʴ�Ϊ��112��
��2�����Ȼ�������NaOH��Һ�У���ʼ�������ƹ�������ʼ������Ӧ��AlCl3+4NaOH�TNaAlO2+3NaCl+2H2O��Ȼ����3NaAlO2+AlCl3+6H2O=4Al��OH��3��+3NaCl��
����������Һ����AlCl3��Һ�У���ʼ������Ӧ��AlCl3+3NaOH�TAl��OH��3��+3NaCl��Ȼ������Ӧ��Al��OH��3+NaOH�TNaAlO2+2H2O��
�ɢں͢ۿ�֪��һ�����ļ����ҷ�Ӧʱ���ҵ���Խ�࣬���ɵij���Խ�٣�����ΪNaOH��Һ������ΪAlCl3��Һ����ΪNaOH��Һ��
�ʴ�Ϊ��AlCl3��
����ʵ��٢ڿ�֪��ʵ�����NaOH���㣬AlCl3��ʣ�࣬����AlCl3+3NaOH�TAl��OH��3��+3NaCl��1.56g���������ʵ���Ϊ$\frac{1.56g}{78g/mol}$=0.02mol����NaOH�����ʵ���Ϊ0.02mol��3=0.06mol����NaOH��Һ�����ʵ���Ũ��Ϊ$\frac{0.06mol}{0.12L}$=0.5mol/L��
�ʴ�Ϊ��0.5mol/L��
���� ���⿼�����ӷ�Ӧ����ʽ�йؼ��㣬Ϊ��Ƶ���㣬ע�⣨2����ȷ�жϼס��ҳɷ��ǽ���ؼ������ؿ���ѧ�������ݵķ�������������������������Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KHCO3��MgCO3 | B�� | K2CO3��Na2CO3 | C�� | MgCO3��Na2CO3 | D�� | KHCO3��NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
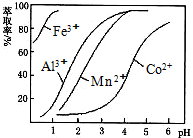
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����缫��Ϊ��Ƭ��M���������������Һ��0.4%��NaOH��Һ | |
| B�� | �����缫��Ϊʯī��M���������������Һ��0.4%��H2SO4��Һ | |
| C�� | �����缫��Ϊʯī��M���������������Һ��0.4%��KOH��Һ | |
| D�� | M����Ƭ����������N��ʯī���������Һ��0.4%��KNO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
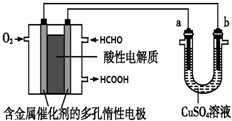
| A�� | ��a��b����ͭ���缫ʱ�������ܷ�Ӧ����ʽΪ��2CuSO4+2H2O $\frac{\underline{\;ͨ��\;}}{\;}$2H2SO4+2Cu+O2�� | |
| B�� | ȼ�ϵ�ع���ʱ��������ӦΪ��O2+2H2O+4e-�T4 OH- | |
| C�� | ��ȼ�ϵ������2.24L ��ȩ����ʱ����·��������ת��2mol e- | |
| D�� | ȼ�ϵ�ع���ʱ��������ӦΪ��HCHO+H2O-2e-�THCOOH+2H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -317.3kJ/mol | B�� | +317.3 kJ/mol | C�� | -379.3kJ/mol | D�� | -332.8kJ/mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com