
【题目】用半透膜把分子或离子从胶体溶液分离出来的方法是( )
A.电泳
B.电解
C.凝聚
D.渗析
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物说法不正确的是
A. CH3CH(OH)CH2COOH系统命名法命名3-羟基丁酸
B. 四苯基乙烯(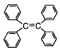 )中所有碳原子一定处于同一平面
)中所有碳原子一定处于同一平面
C. lmol 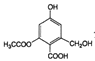 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol
分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别是3mol、4mol、1mol
D. 在一定条件下,苯与液溴、浓硝酸生成溴苯、硝基苯的反应都属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图是由4个碳原子结合成的5种有机物(氢原子没有画出)

(1)写出有机物(a)的习惯命名法的名称______________ 。
(2)有机物(a)有一种同分异构体,写出其结构简式______________ 。
(3)上述有机物中与(c)互为同分异构体的是___________(填代号)。
(4)上述有机物中不能与溴水反应使其褪色的有______________(填代号)。
Ⅱ.写出烷烃C5H12的同分异构体中沸点最低的一种的结构简式_____________。
若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个![]() 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:_________________。
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 gmL﹣1 , 沸点约为55℃.要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 吸热反应在一定条件下也可以发生
B. 需要加热才能发生的反应不一定是吸热反应
C. 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D. 放热反应在常温下一定很容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置I为甲同学设计。

请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为:__________________。
(2)装置I的试管中收集到NO,乙同学认为这也不能确定铜与稀硝酸反应生成的气体是NO,理由是______________________。于是他设计装置II,其中装铜片的是气球。
(3)研究性小组的同学共同对上述实验进行了研究,认为装置II虽然作了改进,但如果按装置II进行实验,还存在问题,需要作相应改进。
①问题一:反应速度较慢。
措施:___________或_________________。
②问题二:试管中的气体是淡棕红色,而不是无色。
措施:现将少量的固体________倒入试管,然后迅速系上装有铜的小气球。
A.Na2SO4 B. CH3COONa C. NaHCO3
③问题三:____________________。
措施:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q
B.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
C.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
(1)在通常状况下,金刚石和石墨相比较, (填”金刚石”或”石墨”)更稳定,石墨的燃烧热为 。

(2)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为 。
Ⅱ、磷在氧气中燃烧,可能生成两种固态氧化物P2O3和P2O5 , P2O5在通常状态下稳定。已知3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,放出X kJ热量。
(3)写出两种磷的氧化物对应的质量(g)为 、 。
(4)已知单质磷的燃烧热为Y kJ/mol,写出1mol P与O2反应生成固态P2O3的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应平衡常数的表达式为 _____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ____________ (选填字母)。
A | B | C | D | |
n(CO2)/mol | 3[ | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5[ | 2 | 3 | 2 |
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com