
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | ______ | 固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
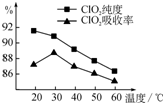 某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成- 3 |
2- 4 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加入KSCN溶液 | 溶液变血红色 溶液变血红色 |
固体物质中有FeCl3 |
| 在酸性KMnO4溶液中加入少量A | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省温州市十校联合体高三上学期期末考试理综化学试卷(解析版) 题型:实验题
草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。
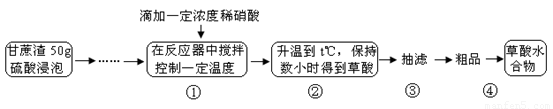


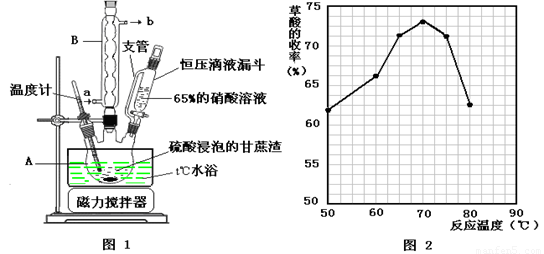
请跟据以上信息回答下列问题:
⑴图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
⑵图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为 ,为了达到图2所示的温度,选择图1的水浴加热,其优点是 。
⑶在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是 。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
⑷要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是 。
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com