
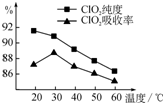
 ij�о�С���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������
ij�о�С���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������- 3 |
2- 4 |
2- 7 |
| 0.05mol��67.5g/mol |
| 6.0g |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������ʡ��Ϫһ�и߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ�ʵ����
��14�֣�ij�о�С��ģ�ҵ���Ի�����Ϊԭ���Ʊ�����ĵ�һ����Ӧ��
4FeS2+11O2 2Fe2O3+8SO2����������ʵ�飬���ⶨ����Ʒ��FeS2��Ʒ�Ĵ��ȣ������������ʲ����뷴Ӧ����
2Fe2O3+8SO2����������ʵ�飬���ⶨ����Ʒ��FeS2��Ʒ�Ĵ��ȣ������������ʲ����뷴Ӧ����
ʵ�鲽�裺��ȡ��ϸ����Ʒ4.000g������ͼbװ���У�Ȼ���ڿ����н������ա�Ϊ�ⶨδ��Ӧ������ص�������������Һ������ֲ��䣩��ʵ����ɺ�ȡ��d����Һ10mL������ƿ���0.1000mol/L����(H2C2O4)����Һ���еζ���
����֪��5SO2 + 2KMnO4 + 2H2O ="=" K2SO4 + 2MnSO4 + 2H2SO4 ��
��ش��������⣺
��1��������Ʒ�����ܷ���������ƽ ����ܡ����ܡ�����
��2��װ��a�������� �������������������� ��
��3��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
��4���ζ�ʱ��������Ӧ�����ӷ���ʽΪ ����֪�ζ��ܳ�����Ϊ0.10mL��ĩ��������ͼ��ʾ,���IJ�����Һ�����Ϊ�� mL��
��5������Ʒ��FeS2�Ĵ���Ϊ ��
��6��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ��� �������ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013������ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��14�֣�ij�о�С��ģ�ҵ���Ի�����Ϊԭ���Ʊ�����ĵ�һ����Ӧ��
4FeS2+11O2 2Fe2O3+8SO2����������ʵ�飬���ⶨ����Ʒ��FeS2��Ʒ�Ĵ��ȣ������������ʲ����뷴Ӧ����
2Fe2O3+8SO2����������ʵ�飬���ⶨ����Ʒ��FeS2��Ʒ�Ĵ��ȣ������������ʲ����뷴Ӧ����

ʵ�鲽�裺��ȡ��ϸ����Ʒ4.000g������ͼbװ���У�Ȼ���ڿ����н������ա�Ϊ�ⶨδ��Ӧ������ص�������������Һ������ֲ��䣩��ʵ����ɺ�ȡ��d����Һ10mL������ƿ���0.1000mol/L����(H2C2O4)����Һ���еζ���

����֪��5SO2 + 2KMnO4 + 2H2O == K2SO4 + 2MnSO4 + 2H2SO4 ��
��ش��������⣺
��1��������Ʒ�����ܷ���������ƽ ����ܡ����ܡ�����
��2��װ��a�������� �������������������� ��
��3��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
��4���ζ�ʱ��������Ӧ�����ӷ���ʽΪ ����֪�ζ��ܳ�����Ϊ0.10mL��ĩ��������ͼ��ʾ,���IJ�����Һ�����Ϊ �� mL��
��5������Ʒ��FeS2�Ĵ���Ϊ ��
��6��������ͼװ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ��� �������ţ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
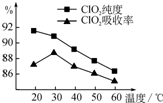 ij�о�С���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������
ij�о�С���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������ ������SO
������SO ����д���Ʊ��������ȣ�ClO2�������ӷ���ʽ��______��
����д���Ʊ��������ȣ�ClO2�������ӷ���ʽ��______��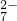 +6Fe2+�T2Cr3++6Fe3++7H2O
+6Fe2+�T2Cr3++6Fe3++7H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com