
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO45H2O)及副产物ZnO.制备流程图如图:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)试剂X可能是 , 其作用是 .
(2)加入ZnO调节pH=3~4的目的是 .
(3)由不溶物生成溶液D的化学方程式为 .
(4)由溶液D制胆矾晶体包含的主要操作步骤是 .
(5)下列试剂可作为Y试剂的是 .
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .
(6)测定胆矾晶体的纯度(不含能与I﹣发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000molL﹣1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I﹣═2CuI(白色)↓+I2 , I2+2S2O32﹣═2I﹣+S4O62﹣
①胆矾晶体的纯度为 .
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会(填“偏高”、“偏低”或“不变”).
【答案】
(1)H2O2;将Fe2+氧化为Fe3+
(2)降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去
(3)Cu+H2O2+H2SO4=CuSO4+2H2O
(4)蒸发浓缩、冷却结晶、抽滤
(5)B;先产生白色沉淀后溶解
(6)97.00%;偏高
【解析】解:(1.)酸性条件下过氧化氢具有氧化性,能氧化亚铁离子生成铁离子,所以试剂X为H2O2 , 所以答案是:H2O2;将 Fe2+氧化为 Fe3+;
(2.)氧化锌为碱性氧化物,能与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去,所以答案是:降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去;
(3.)因为双氧水在酸性溶液中先把铜氧化成氧化铜,当然这是一个微弱的反应,形成一个平衡,但是形成的氧化铜马上就会被稀硫酸溶解,平衡被打破,反应朝正方向进行,故而逐渐溶解,反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,所以答案是:Cu+H2O2+H2SO4=CuSO4+2H2O;
(4.)从溶液中得到固体需要蒸发浓缩、冷却结晶以及抽滤等操作,所以答案是:蒸发浓缩、冷却结晶、抽滤;
(5.)此过程需要调节pH值大于11,故可以加入强碱:NaOH,由于pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣ , 类似与偏铝酸根,加入酸,先生成氢氧化锌沉淀,继续加入酸,沉淀溶解,所以答案是:B;先产生白色沉淀后溶解;
(6.)①CuCl2溶液与KI反应的离子方程式为:2Cu2++4I﹣═2CuI↓+I2 , 且发生I2+2S2O32﹣═2I﹣+S4O62﹣ , 则可得关系式2Na2S2O3 ~2Cu2+ ,
则n(CuSO45H2O)=n(Na2S2O3)=0.100mol/L×19.40×10﹣3L=1.94×10﹣3mol,
m(CuSO45H2O)=1.94×10﹣3mol×250g/mol=0.4850g,
ω(CuSO45H2O)= ![]() ×100%=97.00%,所以答案是:97.00%;
×100%=97.00%,所以答案是:97.00%;
②剧烈摇动锥形瓶,导致氧气参与氧化还原反应,从而消耗Na2S2O3标准溶液体积偏大,故测量纯度偏高,所以答案是:偏高.


科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物.它可由氟碳酸铈精矿经如图1流程制得. 
(1)如图2是一种稀土元素铈(Ce)在元素周期表中的信息示意图.则铈原子的质子数是 , 氟碳酸铈的化学式为CeFCO3 , 该化合物中,Ce的化合价为;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为;
(3)试剂X;
(4)已知298K时,Ksp[Ce(OH)4]=1×10﹣29 , Ce(OH)4的溶度积表达式为Ksp=;为了使溶液中Ce4+沉淀完全,需调节pH为以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL﹣1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积mL,若用硫酸酸化后改用0.1000molL﹣1的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数(填“偏高”、“偏低”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为________。
(2)B中发生反应的化学方程式为_______________。
(3)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为____________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数(用a、c表示)将________(填“偏大”、“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )
A.甲:Na、X:O2
B.甲:NaOH溶液、X:CO2溶液
C.甲:C、X:O2
D.甲:AlCl3溶液、X:NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】猪笼草是一种食虫植物,为了验证猪笼草分泌液中有蛋白酶,某学生设计了两组实验,如下图所示。经35℃水浴保温一段时间后,1、2中各加入适量双缩脲试剂,3、4中不加任何试剂,下列叙述不正确的是 ( )
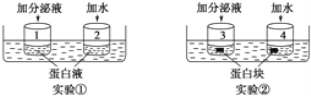
A.实验①、实验②的自变量均是猪笼草分泌液
B.实验①的因变量观察指标为溶液颜色、实验②的因变量观察指标为蛋白块体积
C.实验①、实验②均达到实验目的
D.大幅升高或降低实验温度,可能会影响实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30mL 0.5 mol/L NaOH溶液加水稀释到500 mL,稀释后溶液的浓度为( )
A. 0.1 mol/LB. 0.3 mol/LC. 0.05 mol/LD. 0.03 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
A.溶液中一定不含有CO32﹣ , 可能含有SO42﹣和NO3﹣
B.溶液中的阳离子只有H+、Mg2+、Al3+
C.溶液中n(NH4+)=0.2mol
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4 , 用“C3”表示C3H6O3):
Ⅰ、H2O(l)═2H+(aq)+ ![]() O2(g)+2e﹣△H=+284kJ/mol
O2(g)+2e﹣△H=+284kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)═2C3+(s)△H=+396kJ/mol
Ⅲ、12C3+(s)+12e﹣═C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=﹣1200kJ/mol
(1)写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式 .
(2)降低大气中CO2的含量及有效地开发利用CO2 , 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(Lmin);
②氢气的转化率=;
③该反应的平衡常数表达式为K=;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1 , 然后向容器中再加入一定量H2 , 待反应再一次达到平衡后,H2的物质的量浓度为c2 . 则c12的关系(填>、<、=).
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入氧气一极的电极反应式为;
②随着电池不断放电,电解质溶液的pH(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.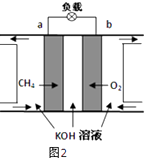
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com