
分析 ①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012>1010,实际上则$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,所以该酸是弱酸,弱酸中存在电离平衡;根据BOH的pH计算出溶液中的氢氧根离子浓度,然后判断电解质强弱;
②加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢氧根离子浓度增大,注意水的离子积常数只与温度有关,与溶液的酸碱性无关;
③A.若混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度;
B.如果二者体积相等,根据酸的强弱判断混合溶液的酸碱性;
C.如果溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.
解答 解:①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸,氢离子浓度为0.1mol/L,氢氧根离子浓度为:10-13mol/L,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012>1010,所以该酸是弱酸;故答案为:弱电解质;
②A.加水稀释促进了弱酸的电离,溶液中氢离子的物质的量增大,HA的物质的量减小,相同溶液中:$\frac{n({H}^{+})}{n(HA)}$,所以其比值增大,故A错误;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以氢氧根离子浓度增大,则$\frac{n(HA)}{c({A}^{-})}$变小,故B正确;
C.c(H+)与c(OH-)的乘积为水的离子积,温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D错误;
故答案为:B;
③A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=1×10-7 mol•L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol•L-1,故A正确;
B.若V1=V2,则酸的浓度大,酸过量,则溶液M的pH一定小于7,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD.
点评 本题考查较为综合,题目难度中等,涉及弱电解质的电离、酸碱混合溶液定性判断及计算等知识,注意掌握弱电解质的电离平衡及其影响因素,明确溶液酸碱性与溶液pH的关系,试题培养学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Ba (OH)2溶液与过量NaHCO3溶液混合离子方程式:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| B. | Na+的结构示意图: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 氢氧化铁的电离方程式:Fe(OH)3═Fe3++3OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥的pH试纸检验CO2 | |
| B. | 用干燥的红色石蕊试纸检验NH3 | |
| C. | SO2能使湿润的品红试纸褪色 | |
| D. | 能使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
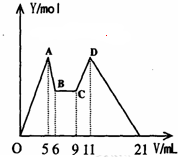 在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )| A. | 9mL | B. | 7.5mL | C. | 7ml | D. | 6mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| B. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{HCl(aq)}{→}$AlCl3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| D. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验方法 | 观察到的现象 |
| 步骤1 | ||
| 步骤2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(H2C2O4)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)=0.04mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com