
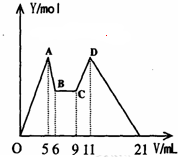
 在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )| A. | 9mL | B. | 7.5mL | C. | 7ml | D. | 6mL |
分析 由图可知,A→B(1 mL)、C→D(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl.根据铝元素守恒:
NaOH-Al(OH)3-AlO2--H+
1 1 1 1
由此可以推出:c(NaOH):c(HCl)=2:1;
依据图象分析在BC段的意义是加入的氢氧化钠溶液和加入盐酸溶液体积之和,依据酸碱反应定量关系,酸碱溶液浓度关系计算得到氢氧化钠溶液体积.
解答 解:由图可知,A→B(1 mL)、C→D(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl,根据铝元素守恒可知:NaOH-Al(OH)3-AlO2--H+,说明反应消耗氢氧化钠和HCl的物质的量相等,由此可以得出:c(NaOH):c(HCl)=2:1,
依据图象分析可知,BC段是加入的氢氧化钠溶液,加入盐酸和氢氧化钠溶液反应,此段中设氢氧化钠溶液体积V1,盐酸体积为V2,则:V1+V2=3,
酸碱中和反应物质的量相同,C1=2C2,V1C1=C2V2,2V1=V2,得到V1=1mL,
则加入氢氧化钠溶液体积为:6mL+1mL=7mL,
故选C.
点评 本题考查了混合物反应的计算、镁铝的性质,题目难度中等,明确图象曲线变化对应反应原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的灵活应用能力.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: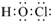 | |
| C. | 中子数为16的硫原子符号为:${\;}_{32}^{16}$S | |
| D. | Na+的离子结构示意图: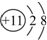 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中含有0.3NA个K+离子 | |
| B. | 1L溶液中含有K+和SO42-离子总数为0.9NA | |
| C. | 2L溶液中含K+的物质的量浓度为1.2mol/L | |
| D. | 2L溶液中含0.6NA个SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5moL/L的AlCl3溶液中含有氯离子数为1.5NA | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 25℃,1.01×105 Pa,11.2 L Cl2含有的氯原子数为1.0 NA | |
| D. | 1 L 0.1 mol/LNaCl溶液中所含的Na+ 的电子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
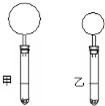 右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )
右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )| A. | 乙试管中盛放的是盐酸溶液 | |
| B. | 甲试管中盛放的是醋酸溶液 | |
| C. | 反应开始时的速率:甲>乙 | |
| D. | 反应结束时消耗碳酸钙的质量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如右图所示的实验结果示意图.以下说法正确的是CD(填标号).
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如右图所示的实验结果示意图.以下说法正确的是CD(填标号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com