
【题目】校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____________________。滴定终点的现象是_________________________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___________ (填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为_____mL。
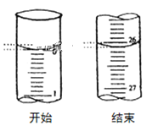
【答案】锥形瓶内溶液颜色变化 由红色变成无色,且半分钟不褪色 D 26.10
【解析】
(1)根据锥形瓶中溶液颜色变化判断终点;滴定前锥形瓶中为氢氧化钠和酚酞,溶液为红色,达到终点时变为无色;
(2)根据c(待测)═![]() 分析误差;
分析误差;
(3)滴定管大刻度在下方,最小读数为0.01mL,据此结合图示分析;
(1)滴定时要根据锥形瓶中溶液颜色变化判断终点,所以眼睛应该观察锥形瓶内溶液颜色变化;滴定前锥形瓶中为氢氧化钠和酚酞,溶液为红色,达到终点时变为无色,则滴定终点的现象是溶液由红色变成无色,且半分钟不褪色,
故答案为:锥形瓶内溶液颜色变化;由红色变成无色,且半分钟不褪色;
(2)根据c(待测)═![]() 分析,
分析,
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成消耗的V(标准)偏大,则测定c(NaOH)偏高,故A错误;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,测定c(NaOH)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,测定c(NaOH)偏高,故C错误;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,测定的c(NaOH)偏低,故D正确;
故答案为:D;
③滴定管能够读到0.01mL,由图可知滴定后读数为26.10mL,
故答案为:26.10。


科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某刚性密闭容器中,充入2molCO和1molNO2,在一定条件下发生反应:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
4CO2(g)+N2(g)。2min时该反应达到平衡,反应前后容器内压强比为12:11。下列判断错误的是( )
A.N2的平衡浓度为0.5mol·L-1
B.2min内NO2的平均反应速率为0.25mol·L-1·min-1
C.反应任意时刻CO和NO2的转化率均相等
D.平衡后再向容器中充入2molCO和1molNO2,再次平衡后,CO的转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
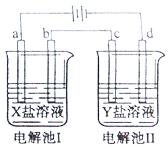
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈___(填“酸”“碱”或“中”)性,其原因是____________(用离子方程式表示)。
(2)比较溶液②③中c (NH4+)②____________③(填“>”、“<”或“=”)
(3)在溶液④中,___的浓度为0.1 mol·L-1(填选项);NH3·H2O和_____离子的浓度之和为0.2 mol·L-1。(填选项)
A .c (NH4+) B. c (Cl-)
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___NH4+的水解程度,(填“>”“<”或“=”),c(CH3COO-)_____ c(NH4+) (填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
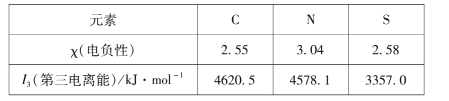
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
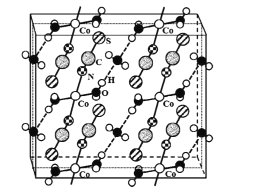
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成,下列说法错误的是
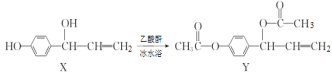
A.X转化成Y为取代反应
B.X、Y分子中含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为3mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:
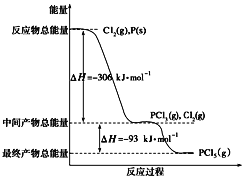
(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时生成标准状况下4.48LCl2,其分解率a1为_________;若反应温度由T1升高到T2,平衡时PCl5的分解率a2,a2______a1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是__________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com