
【题目】在室温下,下列五种溶液:
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈___(填“酸”“碱”或“中”)性,其原因是____________(用离子方程式表示)。
(2)比较溶液②③中c (NH4+)②____________③(填“>”、“<”或“=”)
(3)在溶液④中,___的浓度为0.1 mol·L-1(填选项);NH3·H2O和_____离子的浓度之和为0.2 mol·L-1。(填选项)
A .c (NH4+) B. c (Cl-)
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___NH4+的水解程度,(填“>”“<”或“=”),c(CH3COO-)_____ c(NH4+) (填“>”“<”或“=”)。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ < B A = =
NH3·H2O+H+ < B A = =
【解析】
(1)溶液①0.1 mol·L-1 NH4Cl 呈酸性,原因是铵根离子为弱碱阳离子,水解呈酸性,用离子方程式表示:NH4++H2O![]() NH3·H2O+H+,故答案为:酸;NH4++H2O
NH3·H2O+H+,故答案为:酸;NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(2)比较溶液②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4中c (NH4+),前者是弱酸弱碱盐,醋酸根离子促进铵根离子水解,后者溶液中的氢离子抑制铵根离子水解,c (NH4+):②<③,故答案为:<;
(3)在溶液④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液中,c (Cl-)的浓度为0.1 mol·L-1,故选B;
根据物料守恒:NH3·H2O和c (NH4+)离子的浓度之和为0.2 mol·L-1,故选A;
故答案为:B;A;
(4)室温下,测得溶液②0.1 mol·L-1 CH3COONH4的pH=7,c(OH-) =c(H+),由电荷守恒:c(CH3COO-)+c(OH-) =c(H+)+c(NH4+),则说明CH3COO-的水解程度等于NH4+的水解程度,c(CH3COO-)= c(NH4+)。
故答案为:=;=。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.75 | 4.62 | 4.56 | 4.55 | 4.54 |
分析数据,回答以下问题:
①雨水样品呈酸性的原因是________________________________(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水(含有氯气)混合,pH将________(填“变大”“变小”或“不变”)。
(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,其原因可能是_______(用化学方程式表示)。
(3)举一例说明这种雨水将给环境中的生物或非生物造成的影响________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
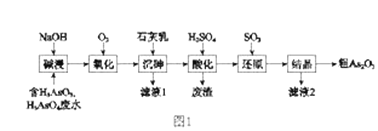
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
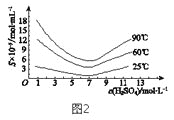
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴酚酞做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____________________。滴定终点的现象是_________________________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是___________ (填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
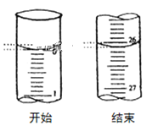
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物他莫肯芬(Tamoxifen)的一种合成路线如图所示:

已知:![]() +HBr
+HBr![]() +RBr
+RBr

回答下列问题。
(1)A+B→C的反应类型为__;C中官能团有醚键、__(填名称)。
(2)CH3CH2I的名称为__。
(3)反应D→E的化学方程式为__。
(4)Tamoxifen的结构简式为__。
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为__、__(写2种)。
(6)设计用 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化,下列说法正确的是( )
CH3OH(g)+H2O(g)。将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化,下列说法正确的是( )

A.反应开始至a点时v(H2)=1mol·L-1·S-1
B.若曲线I对应的条件改变是升高温度,则该反应△H>0
C.曲线II对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2mol·L-1<c(CH3OH)<8/3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中NO是主要成分之一。
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化学方程式____________________。

(2)FeSO4-Na2SO3复合吸收剂吸收烟气中的NO,该方法利用Fe2+易与NO发生络合反应的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如图是一段时间内不同吸收剂对NO脱除率对比,加入Na2SO3溶液后,吸收效率增强,除了Na2SO3也能吸收部分NO外,还能防氧化从而增大Fe2+的含量,写出此原理的离子方程式_______________________________________。

②模拟实验表明,温度过高或过低都会降低NO的脱除率,其原因是_______________________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成NO3-,原理如图

①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出NO发生反应的离子方程式____________________________。
③根据下图所示,脱NO过程中控制溶液pH在______________范围内更合理。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com