
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
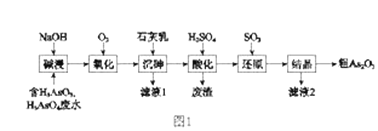
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
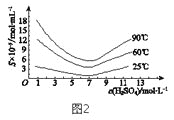
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
【答案】 H3AsO4+3NaOH═Na3AsO4+3H2O 0.5 温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降 H3AsO4+H2O+SO2═H3AsO3+H2SO4 调硫酸浓度约为7molL-1,冷却至25℃,过滤 abc
【解析】试题分析:(1)H3AsO4与氢氧化钠发生中和反应生成Na3AsO4;(2)根据电子守恒计算1molAsO33-转化为AsO43-至少需要O2的物质的量;(3)温度升高,Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,所以反应b平衡逆向移动;(4)H3AsO4被SO2还原成H3AsO3;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小;(6)CaSO4微溶于水;滤液2含有少量As2O3、硫酸;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素;
Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,所以反应b平衡逆向移动;(4)H3AsO4被SO2还原成H3AsO3;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小;(6)CaSO4微溶于水;滤液2含有少量As2O3、硫酸;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素;
解析:(1)H3AsO4与氢氧化钠发生中和反应生成Na3AsO4,反应方程式是H3AsO4+3NaOH═Na3AsO4+3H2O;(2)1molAsO33-转化为AsO43-失电子2mol,1mol氧气得电子4mol,根据电子守恒,需要O2的物质的量![]() ;(3)温度升高,Ca(OH)2(s)
;(3)温度升高,Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,反应b平衡逆向移动,所以随温度升高沉淀率下降;(4)H3AsO4被SO2还原成H3AsO3反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小,为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是调硫酸浓度约为7molL-1,冷却至25℃,过滤;(6)CaSO4微溶于水,钙离子未完全除去,所以粗As2O3中含有CaSO4,故a正确;滤液2含有少量As2O3、硫酸,滤液2可循环使用,提高砷的回收率,故b正确;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素,故c正确。
Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,反应b平衡逆向移动,所以随温度升高沉淀率下降;(4)H3AsO4被SO2还原成H3AsO3反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小,为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是调硫酸浓度约为7molL-1,冷却至25℃,过滤;(6)CaSO4微溶于水,钙离子未完全除去,所以粗As2O3中含有CaSO4,故a正确;滤液2含有少量As2O3、硫酸,滤液2可循环使用,提高砷的回收率,故b正确;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素,故c正确。


科目:高中化学 来源: 题型:
【题目】下列有关物质的量浓度关系中,不正确的是:
A. 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 浓度相同的下列溶液: ①(NH4) 2 Fe(SO4)2 ②(NH4) 2 CO3 ③(NH4) 2SO4 ,NH4+浓度由大到小的顺序是:①>③>②
C. 浓度均为0.1 mol·L-1CH3COONa、NaHCO3、![]() -ONa溶液中:若c(OH-)分别为c1、c2、c3,则c3>c2>c1
-ONa溶液中:若c(OH-)分别为c1、c2、c3,则c3>c2>c1
D. NaHCO3溶液中:c(Na+)=c(H2CO3)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,美国麻省理工学院基于葡萄糖开发了一种新型燃料电池,以Pt/TiO2为电极,植入人体就可以进行工作,如图是人工模拟此电池的示意图,下列叙述正确的是 ( )
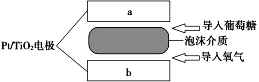
A. 电极a上发生还原反应
B. 电池总反应式为C6H12O6+6O2―→6CO2+6H2O
C. 两个电极材料相同,不能形成燃料电池
D. b极的电极反应式为C6H12O6+6H2O-24e-===6CO2+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4在O2中燃烧生成CO2和气态H2O的反应是一个放热反应,在反应过程中
A. 核能转化成热能 B. 化学能转化成热能
C. 生成物的总能量等于反应物的总能量 D. 生成物的总能量大于反应物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq)![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A. 存在关系式:c/ab3=z/xy3
B. 存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C. 向溶液中加入少量铁粉,溶液颜色变浅
D. 当溶液中c(SCN-)保持不变时达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
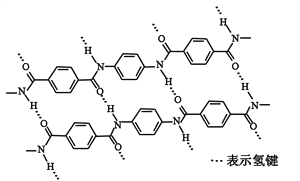
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

下列说法中正确的是
A. 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com