
【题目】据报道,美国麻省理工学院基于葡萄糖开发了一种新型燃料电池,以Pt/TiO2为电极,植入人体就可以进行工作,如图是人工模拟此电池的示意图,下列叙述正确的是 ( )
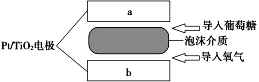
A. 电极a上发生还原反应
B. 电池总反应式为C6H12O6+6O2―→6CO2+6H2O
C. 两个电极材料相同,不能形成燃料电池
D. b极的电极反应式为C6H12O6+6H2O-24e-===6CO2+24H+
科目:高中化学 来源: 题型:
【题目】下列操作中最终可以得到Al(OH)3的是( )
A. Al2O3和水混合加热 B. Al和水反应
C. 过量的NaOH溶液加入到AlCl3溶液中 D. 过量的氨气通入到AlCl3溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。
)是合成橡胶和塑料的重要单体,也是生产某些药物、农药的中间体。化合物E是一种昆虫信息素,可以通过以下流程制备。

完成下列填空:
(1)反应②的反应类型__________;上述流程中的物质,与B互为同分异构体是__________。写出B的属于芳香烃的一种同分异构体的结构简式__________,该物质的名称为_________。
(2)反应①中,A和苯按摩尔比1:1完全反应,产物只有B。写出A的结构简式___________。
(3)写出反应③的化学方程式____________________________________。
(4)以B为原料制取C的反应是可逆反应,分离C、B混合物的实验操作为____________。
(5)苯乙烯露置于空气中可被氧化为苯甲醛和甲醛。设计实验方案检验苯乙烯样品是否被氧化变质______________________________________。
(6)参照上述合成路线的表示方法,设计以苯乙烯为原料经过三步反应制备新型高分子导电材料PPA(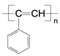 )的合成路线,并注明必要的反应条件。(无机物任选)_____________
)的合成路线,并注明必要的反应条件。(无机物任选)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔生理学或医学奖。研究团队发现在温度较高时未能提取到青蒿素,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。下面反应是青蒿素在一定条件下转化为双氢青蒿素:

以下说法不正确的是( )
A. 较高温度下未能提取到青蒿素的原因与分子中存在非极性的O—O键的不稳定性有关
B. 青蒿素和双氢青蒿素均能使湿润的淀粉-碘化钾试纸变蓝色
C. 双氢青蒿素比青蒿素的水溶性好,所以治疗疟疾的效果更好
D. 青蒿素属于酯类化合物,分子中碳原子采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
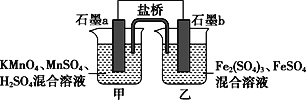
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
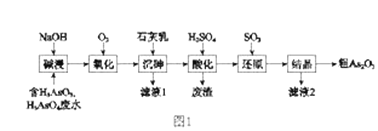
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
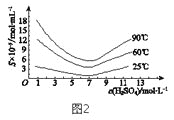
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的分子式为____________。
(2)D中含有的官能团是____________,分子中最多有____________个碳原子共平面。
(3)①的反应类型是____________,③的反应类型是____________。
(4)⑤的化学方程式为________________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线: _____________。
的合成路线: _____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com