
【题目】CH4在O2中燃烧生成CO2和气态H2O的反应是一个放热反应,在反应过程中
A. 核能转化成热能 B. 化学能转化成热能
C. 生成物的总能量等于反应物的总能量 D. 生成物的总能量大于反应物的总能量
 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】有人说:“Na2O2脾气火爆,一见二氧化碳就变脸, 遇见水就生气”。这种说法引起了某学习小组的兴趣,于是对Na2O2性质进行以下实验探究。
完成下列填空:
(1)实验装置如图所示。挤压胶头滴管,预期看到的实验现象________________、__________(写出2条主要现象)。
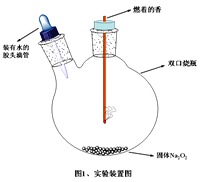
(2)写出Na2O2遇CO2“变脸”的化学方程式____________。若Na2O2长期露置于空气中,最终会转化为_________(填物质名称)。
(3)某同学发现Na2O2见水“生气”后所得溶液温度升高,滴加酚酞试液,酚酞先变红,但很快就褪色。对此设计实验进行探究:取两支试管分别加入少量Na2O2粉末,一支冰水浴,一支热水浴,两支试管里都滴加蒸馏水和酚酞。该实验的目的是__________________________。另一同学将实验改为:取两支试管,分别加入滴有酚酞的红色NaOH溶液,一支冰水浴,一支热水浴。你认为改后能否达到原实验目的____________,理由_______________________________。
(4)根据Na2O2的性质,指出它的一种用途_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔生理学或医学奖。研究团队发现在温度较高时未能提取到青蒿素,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。下面反应是青蒿素在一定条件下转化为双氢青蒿素:

以下说法不正确的是( )
A. 较高温度下未能提取到青蒿素的原因与分子中存在非极性的O—O键的不稳定性有关
B. 青蒿素和双氢青蒿素均能使湿润的淀粉-碘化钾试纸变蓝色
C. 双氢青蒿素比青蒿素的水溶性好,所以治疗疟疾的效果更好
D. 青蒿素属于酯类化合物,分子中碳原子采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
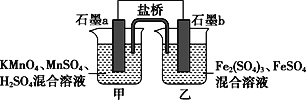
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 在a mol金刚石中含有C—C键的个数为N= 2a×6.02×1023
B. 热稳定性:MgCO3 > CaCO3
C. 熔点:MgO < MgCl2
D. 沸点:Na < K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。
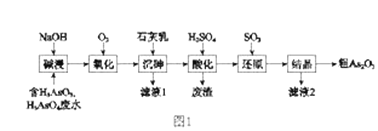
(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
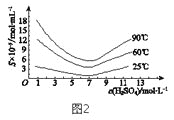
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y能用于高性能光学树脂的合成,可由化合物X与2甲基丙烯酰氯在一定条件下反应制得:
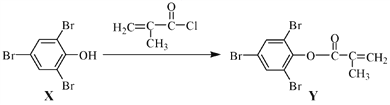
下列有关化合物X、Y的说法正确的是
A. X分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中不含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 1 mol重水(D2O)与1 mol水(H2O)中,中子数比为5∶4
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com