
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】翡翠是玉石中的一种,其主要成分为硅酸铝钠NaAl(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。请回答下列问题:
(1)基态镍原子的外围电子排布图为___________;与其同周期的基态原子的M层电子全充满的元素位于周期表的__________、___________区。
(2)翡翠中主要成分硅酸铝钠中四种元素电负性由小到大的顺序是___________。
(3)铬可以形成CrCl3·x NH3(x=3、4、5、6)等一系列配位数为6的配合物。
①NH3分子的ⅤSEPR模型是___________。
②键角大小关系NH3___________PH3(填“>”<”或“=”)。
③NF3不易与Cr3+形成配离子,其原因是___________。
(4)铁有δ、γ、α三种同素异形体,如下图所示。
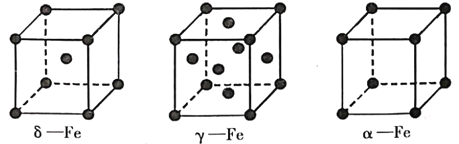
γ-Fe晶体的一个晶胞中所含有的铁原子数为___________,δ-Fe、α-Fe两种晶胞中铁原子的配位数之比为___________。已知δ-Fe晶体的密度为dg/cm,NA表示阿伏伽德罗常数的数值,则Fe原子半径为___________pm(列表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或名称表述不正确的是( )
A.葡萄糖的分子式:C6H12O6
B.HCl的电子式:![]()
C. 的名称:2﹣甲基丙烷
的名称:2﹣甲基丙烷
D.含有10个中子的氧原子可表示为:![]() O
O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构简式可以用“键线式”表示,其中线表示键,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。已知利用某些有机物之间的转化可贮存太阳能,如降冰片二烯(NBD)经太阳光照射转化成四环烷(Q)的反应为 (反应吸热),下列叙述中错误的是( )
(反应吸热),下列叙述中错误的是( )
A. NBD和Q互为同分异构体
B. Q可使溴水褪色
C. Q的一氯代物只有3种
D. NBD的同分异构体可以是芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
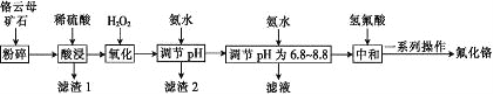
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com