
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
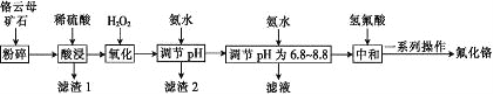
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。
【答案】增大接触面积,提高浸取率,加快浸取速率 Cr2O3+3H2SO4=Cr2(SO4)3+3H2O 4.1~4.9(或4.1≤pH<4.9) 使Cr3+完全沉淀,Mg2+不沉淀 Cr(OH)3+OH-=Cr(OH)4-
【解析】
铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2),加硫酸酸浸溶解,其中SiO2不与硫酸反应,则滤渣1为SiO2,过滤后得到含有Cr3+、Mg2+、Fe2+、Fe3+、SO42-的溶液,根据题中表格提供的相关金属离子生成氢氧化物沉淀的pH,为了把杂质铁元素除去,加入双氧水将Fe2+氧化为Fe3+,加入氨水调节pH范围为4.1~4.9,使Fe3+完全沉淀转化为Fe(OH)3,为了将使Cr3+与Mg2+彻底分离,根据流程结合金属离子生成氢氧化物沉淀的pH,由于Cr(OH)3与 Al(OH)3 一样具有两性,不能使用强碱使Cr3+完全沉淀,再次加入氨水调节pH 为6.8~8.8,使Cr3+完全沉淀,Mg2+不沉淀,再次过滤,滤液中为Mg2+,得到Cr(OH)3沉淀,用氢氟酸与Cr(OH)3反应转化氟化铬,在经过一系列操作,最后得到产品。
(1) 铬云母矿石粉碎的目的是增大接触面积,提高浸取率,加快浸取速率,
故答案为:增大接触面积,提高浸取率,加快浸取速率;
(2)Cr2O3与稀硫酸反应的化学方程式为Cr2O3+3H2SO4=Cr2(SO4)3+3H2O,
答案为:Cr2O3+3H2SO4=Cr2(SO4)3+3H2O;
(3)第一次滴加氨水调节pH范围为4.1~4.9,
答案为:4.1~4.9(或4.1≤pH<4.9);
(4)第二次滴加氨水调节pH 为6.8~8.8的目的使使Cr3+完全沉淀,Mg2+不沉淀;Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,该反应的离子方程式为Cr(OH)3+OH-=Cr(OH)4-,
答案为:使Cr3+完全沉淀,Mg2+不沉淀,Cr(OH)3+OH-=Cr(OH)4-。


科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
反应前各物质的物质的量/mol
A | B | C | |
甲 | 1 | 3 | 0 |
乙 | 0 | 0 | 2 |
丙 | 1.5 | 4.5 | 1 |
A.乙中5min内C的反应速率为0.16mol-1·min-1
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲、乙两容器中C的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确

A.t°C时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家已经研制出世界上最薄的材料——碳膜片,其厚度只有一根头发的二十万分之一。如图所示,这种碳膜片形状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
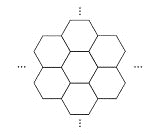
A. 碳膜片属于一种新型的化合物
B. 碳膜片与石墨的结构相同
C. 碳膜片与C60互为同素异形体
D. 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国科学家希尔发现,离体的叶绿体悬浮液中加入适当的电子受体(如草酸铁),在光照时可使水分解而释放氧气,从而证明了氧的释放与CO2还原是不同的过程,将对光合作用的研究上升到细胞层面。该反应方程式为4Fe3++2H2O![]() 4Fe2++4H++O2↑,下列有关希尔反应说法错误的是( )
4Fe2++4H++O2↑,下列有关希尔反应说法错误的是( )
A. 水在光反应中起供氢体和电子供体双重作用
B. 反应后溶液pH减小
C. 生成标准状况下11.2 L O2时,Fe3+得电子数为2NA
D. 叶绿体本身被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性、高效催化性等优良的性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为__________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2_________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为__________________。
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570 ℃时生成FeO,高于570 ℃时生成Fe3O4。甲同学用如图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
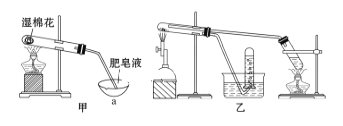
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是____________。
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
① | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向实验①得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。丙同学认为乙同学的结论不正确,他的理由是________(用简要文字描述)。
(6)丁同学称取5.60 g Fe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g,则丁同学实验后的固体物质中氧化物的质量分数为___(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ![]() 从海水得到的粗食盐水中常含
从海水得到的粗食盐水中常含![]() 、
、![]() 、
、![]() ,需要分离提纯
,需要分离提纯![]() 现有含少量
现有含少量![]() 、
、![]() 的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂
的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂![]() 盐酸、
盐酸、![]() 、
、![]() 、
、![]() 来除去食盐水中
来除去食盐水中![]() 、
、![]() 、
、![]() 提纯时的操作步骤和加入试剂的情况如图1。
提纯时的操作步骤和加入试剂的情况如图1。
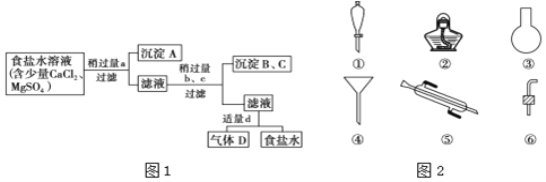
图1中a、b、c、d分别表示上述4种试剂中的一种,试回答:
![]() 沉淀A的名称是______.
沉淀A的名称是______.
![]() 试剂d是______;判断试剂d适量的方法是______.
试剂d是______;判断试剂d适量的方法是______.
![]() 加入b、c后溶液中发生的化学反应的化学方程式为______.
加入b、c后溶液中发生的化学反应的化学方程式为______.
Ⅱ![]() 海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的______
海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的______![]() 填序号
填序号![]() ,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做______.
,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com