
【题目】Ⅰ![]() 从海水得到的粗食盐水中常含
从海水得到的粗食盐水中常含![]() 、
、![]() 、
、![]() ,需要分离提纯
,需要分离提纯![]() 现有含少量
现有含少量![]() 、
、![]() 的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂
的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂![]() 盐酸、
盐酸、![]() 、
、![]() 、
、![]() 来除去食盐水中
来除去食盐水中![]() 、
、![]() 、
、![]() 提纯时的操作步骤和加入试剂的情况如图1。
提纯时的操作步骤和加入试剂的情况如图1。
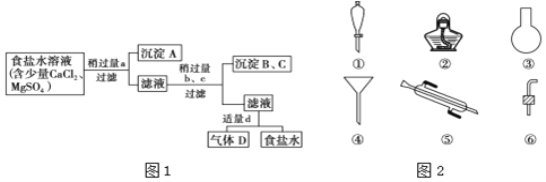
图1中a、b、c、d分别表示上述4种试剂中的一种,试回答:
![]() 沉淀A的名称是______.
沉淀A的名称是______.
![]() 试剂d是______;判断试剂d适量的方法是______.
试剂d是______;判断试剂d适量的方法是______.
![]() 加入b、c后溶液中发生的化学反应的化学方程式为______.
加入b、c后溶液中发生的化学反应的化学方程式为______.
Ⅱ![]() 海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的______
海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要图2仪器中的______![]() 填序号
填序号![]() ,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做______.
,向该碘水中加入四氯化碳以提取碘单质的实验操作叫做______.
【答案】硫酸钡 盐酸 溶液不再产生气体 MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl ① 萃取
【解析】
(1)现有含少量![]() 、
、![]() 的粗食盐水进行提纯,需要除去钙离子和镁离子和硫酸根离子,钙离子转化为碳酸钙沉淀,镁离子转化为氢氧化镁沉淀,硫酸根离子转化为硫酸钡沉淀,为了能完全除去,所以加入试剂均过量,注意后面要能将剩余的杂质离子除去,所以先加入氯化钡溶液,再加入碳酸钠或氢氧化钠,待沉淀完全后过滤,再加入盐酸除去剩余的氢氧根离子和碳酸根离子。
的粗食盐水进行提纯,需要除去钙离子和镁离子和硫酸根离子,钙离子转化为碳酸钙沉淀,镁离子转化为氢氧化镁沉淀,硫酸根离子转化为硫酸钡沉淀,为了能完全除去,所以加入试剂均过量,注意后面要能将剩余的杂质离子除去,所以先加入氯化钡溶液,再加入碳酸钠或氢氧化钠,待沉淀完全后过滤,再加入盐酸除去剩余的氢氧根离子和碳酸根离子。
(2)根据碘在四氯化碳等有机溶剂中的溶解度比在水中大分析,采用萃取分液的方法提纯。
Ⅰ![]() (1)先加入氯化钡溶液,沉淀A为硫酸钡;
(1)先加入氯化钡溶液,沉淀A为硫酸钡;
(2)试剂d为盐酸,盐酸和碳酸钠反应生成二氧化碳,判断其适量的方法为采用滴加的方式,看是否有气泡产生,若无气泡,说明盐酸适量;
(3)加入氢氧化钠溶液,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,加入碳酸钠溶液,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠。方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+BaCl2=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl;
Ⅱ![]() 从碘水中提取碘,用萃取分液的方法,使用分液漏斗,选择①;碘水加入四氯化碳的操作方法为萃取。
从碘水中提取碘,用萃取分液的方法,使用分液漏斗,选择①;碘水加入四氯化碳的操作方法为萃取。


科目:高中化学 来源: 题型:
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
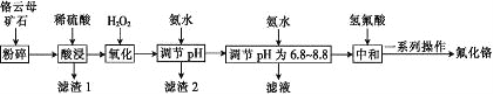
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (15分)研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
e.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤b中不断搅拌的目的是_______。②步骤c中发生反应的离子方程式为______。③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2) 高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3) 高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
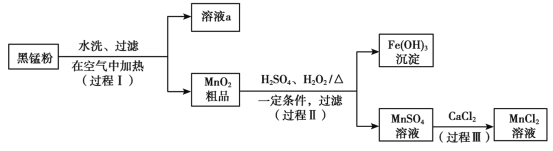
(1)过程Ⅰ中,在空气中充分加热黑锰粉的目的主要是除去__________和氧化锰元素,请写出含Mn元素的物质发生反应的化学方程式____________________________。
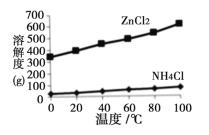
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。根据右图所示的溶解度曲线,将溶液a经___________、_______________、过滤可得NH4Cl粗品。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入____________(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①用化学方程式表示ⅱ中MnO2溶解的原因:__________________。
②解释试剂加入顺序不同,MnO2作用不同的原因:_______________________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是( )
H+ + O22-)下列分析不正确的是( )

A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同
D.通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数![]() (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
压强/MPa | 10 | 20 | 30 | 40 |
| 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
A.10 MPa时,H2的转化率为75%
B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍
C.40 MPa时,若容器的体积为V L,则平衡常数K=![]()
D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气![]() 进行此实验,所用仪器如图:
进行此实验,所用仪器如图:
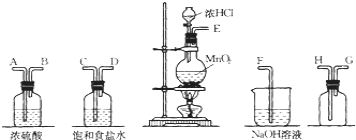
![]() 连接上述仪器的正确顺序是:____________。
连接上述仪器的正确顺序是:____________。
![]() 气体发生装置中进行的反应化学方程式是 ______ ;当
气体发生装置中进行的反应化学方程式是 ______ ;当![]() 参与反应时,被氧化的HCl的质量为 ______ 。
参与反应时,被氧化的HCl的质量为 ______ 。
![]() 在装置中:
在装置中:![]() 饱和食盐水的作用是 ______。
饱和食盐水的作用是 ______。
![]() 化学实验中检验是否有
化学实验中检验是否有![]() 产生常用湿润的淀粉
产生常用湿润的淀粉![]() 试纸
试纸![]() 如果有
如果有![]() 产生,可观察到的现象是 ______ ,写出反应方程式 ______ 。
产生,可观察到的现象是 ______ ,写出反应方程式 ______ 。
![]() 写出尾气吸收装置中进行的反应的化学方程式 ______ 。
写出尾气吸收装置中进行的反应的化学方程式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com