
����Ŀ��������2 L���ݵ������У��ֱ�����ӦA��g��+3B��g��![]() 2C��g����5min���������Ӧ��ƽ��״̬�����м�������A�����ʵ���Ϊ0.4 mol������˵����ȷ���ǣ���
2C��g����5min���������Ӧ��ƽ��״̬�����м�������A�����ʵ���Ϊ0.4 mol������˵����ȷ���ǣ���
��Ӧǰ�����ʵ����ʵ���/mol
A | B | C | |
�� | 1 | 3 | 0 |
�� | 0 | 0 | 2 |
�� | 1.5 | 4.5 | 1 |
A.����5min��C�ķ�Ӧ����Ϊ0.16mol-1��min-1
B.�ﵽƽ��ʱ������A��Ũ���Ǽ��е�2��
C.���з�Ӧ��ƽ�ⳣ�����ڼ��з�Ӧ��ƽ�ⳣ��
D.�ﵽƽ��ʱ���ס�����������C�����ʵ������
���𰸡�D
��������
���õ�Чƽ����з�����
��������ӦA��g��+3B��g��![]() 2C��g��
2C��g��
��ʼ��mol�� 1 3 0
�仯��mol�� 0.6 1.8 1.2
ƽ�⣨mol�� 0.4 1.2 1.2
�������кͼ������ﵽ��ͬƽ��״̬
������A��g��+3B��g��![]() 2C��g��
2C��g��
��ʼ��mol�� 0 0 2
�仯��mol�� 1.2 1.2 0.8
ƽ�⣨mol�� 1.2 1.2 1.2
���������б��дﵽƽ��
A��g��+3B��g��![]() 2C��g��
2C��g��
1.5 4.5 1
��ʼ�����Կ���Ϊ2 6 0���൱�ڼ�������2�����÷�ӦΪ���������С�ķ�Ӧ����ѹǿ����ƽ��������Ӧ������У�
A�����������������ﵽ��ͬ��ƽ��״̬�����ݷ�����֪Ӧ����C�����ʵ���Ϊ0.8mol������5min��C�ķ�Ӧ����Ϊ![]() =0.08mol/(L��min)����A����
=0.08mol/(L��min)����A����
B���������е���ʼ���൱�ڼ�������2�������÷�ӦΪ���������С��ѹǿ����ƽ��������Ӧ������У������A��Ũ�ȱȼ������е�2��С����B����
C����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�ͱ������¶���ͬ������ѧƽ�ⳣ�����䣬��C����
D�����������������ﵽƽ��ʱ������������C�����ʵ�����ȣ���D��ȷ��
��ѡD��


 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��������Ʊ�������ȷ���ǣ� ��
A.�����ǵķ���ʽ��C6H12O6
B.HCl�ĵ���ʽ��![]()
C. �����ƣ�2��������
�����ƣ�2��������
D.����10�����ӵ���ԭ�ӿɱ�ʾΪ��![]() O
O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧͨ��ʵ���о�FeCl3��Һ��Cu�۷�����������ԭ��Ӧ��ʵ���¼���£�
��� | I | II | III |
ʵ�鲽�� |
���������2mL����ˮ |
���������2mL����ˮ |
���������2mL����ˮ |
ʵ������ | ͭ����ʧ����Һ��ɫ��dz����������ˮ������������ | ͭ����ʣ�࣬��Һ��ɫ��ȥ����������ˮ�����ɰ�ɫ���� | ͭ����ʣ�࣬��Һ��ɫ��ȥ�������ɫ����������ˮ���ް�ɫ���� |
����˵������ȷ����
A. ʵ��I��II��III�о��漰Fe3+����ԭ
B. �Ա�ʵ��I��II˵����ɫ�����IJ�����ͭ�۵����й�
C. ʵ��II��III�м�������ˮ��c(Cu2+)��ͬ
D. ��ʵ��III��Ӧ�����Һ�м��뱥��NaCl��Һ���ܳ��ְ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����������������������ȷ���� �� ��
A.��״���£�22.4L CCl4���еķ�����Ϊ1NA
B.ͨ��״���£�NA��CO2����ռ�е����Ϊ22.4L
C.���³�ѹ�£�1.06g Na2CO3����ˮ����Һ�к�Na+������Ϊ0.02NA
D.Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl��ΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƺ�����ǹŴ��Ͷ�������ǻ۽ᾧ���ƺʹ�Ҳ���ճ������г������л��
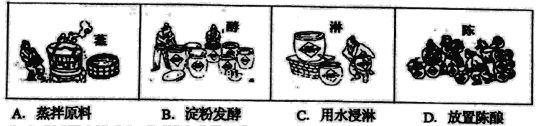
(1)�����Ը���Ϊ��Ҫԭ�ϵ�������У����ô����ܽ��Ե���_________(��ѡ��)��
(2)д��������ˮ��Һ�еĵ���ƽ�ⳣ���ı���ʽ________��
(3)��֪25���£�CH3COOH��ˮ�е���ĵ��볣��Ka��2��10��5����25��ʱCH5COONaˮ��ƽ�ⳣ��Kh��_________(����ֵ)��
(4)���������о����������Ὺ�����¹��պϳ�����������ʹ��Ʒ�ɱ����Խ��ͣ�����Ҫ��ӦΪ�� CH2��CH2 (g)��CH3COOH(l) ![]() CH3COOC2H5(l)��
CH3COOC2H5(l)��
�ٸ÷�Ӧ�����л���Ӧ�����е�___________��
������������˵����ϩ������ϳ����������ķ�Ӧ�Ѵﻯѧƽ�����_________(��ѡ��)��
A ��ϩ�����ᡢ����������Ũ����ͬ
B �����ϳɷ�Ӧ�����������ֽⷴӦ���������
C ��ϩ�Ͽ�l mol̼̼˫����ͬʱ����ǡ������l mol
D ��ϵ������İٷֺ���һ��
(5)��ͼΪn(��ϩ)��n(����)���ϱ�Ϊ1ʱ���ڲ�ͬѹǿ�½��������������IJ������¶ȱ仯�IJⶨʵ�飬����ͬʱ����ʵ������ͼ��ʾ���ش��������⣺
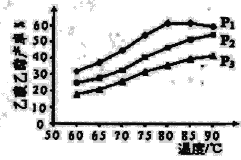
���¶���60��80�淶Χ�ڣ���ϩ�����������ϳɷ�Ӧ�����ɴ�С��˳����_______[��v(P1)��v(P2)��v(P3)�ֱ��ʾ��ͬѹǿ�µķ�Ӧ����]��
��ѹǿΪP1 MPa���¶�60��ʱ�������������IJ���Ϊ30%�����ʱ��ϩ��ת����Ϊ_______��
��ѹǿΪP1 MPa���¶ȳ���80��ʱ���������������½���ԭ�������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����Ŀ��
(1)�õ����ű�ʾ���з�Ӧ�е���ת�Ʒ������Ŀ��KIO3+5KI+3H2SO4�T3K2SO4+3I2+3H2O_____
(2)��Ԫ�����������ij���Ԫ�أ����е�ϸ������Ҫ��Ԫ�أ��ⶨ����ѪҺ�и�Ԫ�صĺ������õ�����������Ӧ����CaC2O4+H2SO4=H2C204+CaSO4��2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2��+8H2O��������Ӧ�ڵĻ�ԭ����___�����ռ���44.8mL����״������CO2ʱ������������___mol����__mol���ӷ���ת�ƣ��൱�ڲ������Ԫ�ص�������__g��
(3)ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ������������Fe(OH)3��ClO����OH����FeO42-��Cl����H2O��д�������������Ƹ�����ص����ӷ�Ӧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ë֯Ʒ��������±������������ʯӲ������ɫ�����Ը���ĸ��ʯ(��4.5%Cr2O3,����Fe2O3��FeO��MgO��SiO2)Ϊԭ���Ʊ��������Ĺ����������¡�
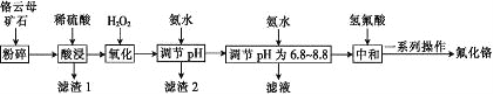
�±��г�����ؽ������������������������pH:
�������� | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
��ʼ������pH | 2.3 | 8.8 | 4.9 | 7.5 |
������ȫ��pH | 4.1 | 10.4 | 6.8 | 9.7 |
��ش���������:
(1)������ĸ��ʯ�����Ŀ����___________��
(2)Cr2O3��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ________________��
(3)��һ�εμӰ�ˮ����pH��ΧΪ______��
(4)�ڶ��εμӰ�ˮ����pH Ϊ6.8~8.8��Ŀ����___________,Cr(OH)3�� Al(OH)3 һ���������ԣ����ڶ��εμӵİ�ˮ��ΪNaOH��Һ�����ɵ�Cr(OH)3�Ჿ���ܽ⣬д��Cr(OH)3�ܽ�����ӷ���ʽ:___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Al��Cl2��Al2O3��HCl(aq)��Al(OH)3��NaOH(aq)�������ʣ�����֮������ͼ��ʾ��ת����ϵ��ͼ��ÿ�������˵�����֮�䶼���Է�����Ӧ�������ƶϲ��������ǣ� ��
![]()
A.X����ΪAl��Cl2
B.Yһ��ΪNaOH(aq)
C.Nһ����HCl(aq)
D.Q��Z�е�һ�ֱ�ΪAl2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�п�̵���еĺ��̷ۣ�MnO2��MnO��OH����NH4Cl������ZnCl2��̿�ڡ��������ȣ�Ϊԭ���Ʊ�MnCl2��ʵ���̵������á��乤���������£�
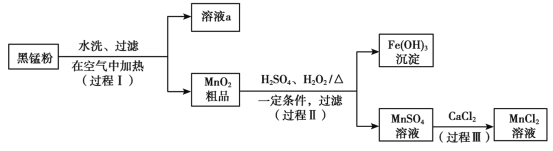
��1�����̢��У��ڿ����г�ּ��Ⱥ��̷۵�Ŀ����Ҫ�dz�ȥ__________��������Ԫ�أ���д����MnԪ�ص����ʷ�����Ӧ�Ļ�ѧ����ʽ____________________________��
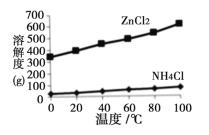
��2����Һa����Ҫ�ɷ�ΪNH4Cl�������������ZnCl2�ȡ�������ͼ��ʾ���ܽ�����ߣ�����Һa��___________��_______________�����˿ɵ�NH4Cl��Ʒ��
��3������MnSO4��Һ���Ƿ���Fe3����ȡ������Һ������____________�����Լ�������֤����Һ��Fe3��������ȫ��
��4��̽�����̢���MnO2�ܽ������������
��.��MnO2�м���H2O2��Һ�������������ݣ��ټ���ϡH2SO4������δ�����ܽ⡣
��.��MnO2�м���ϡH2SO4������δ�ܽ⣻�ټ���H2O2��Һ�������������ݣ�������ȫ�ܽ⡣
���û�ѧ����ʽ��ʾ����MnO2�ܽ��ԭ��__________________��
�ڽ����Լ�����˳��ͬ��MnO2���ò�ͬ��ԭ��_______________________��
����ʵ��˵�����Լ�����˳��ͬ���������ֵ����ʿ��ܲ�ͬ������Ҳ���ܲ�ͬ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com