
����Ŀ�������л���֮���ת����ϵ�Լ�ת��������Է��������仯��ϵ���£�
����ת����ϵ��RCH2OH ![]() RCHO
RCHO![]() RCOOH
RCOOH
��Է���������M M2M+14
��֪������A��ֻ����C.H��O����Ԫ�أ�һ���������ܷ���������Ӧ������C����Է�������Ϊ104.A����������֮���ת����ϵ��ͼ��ʾ��
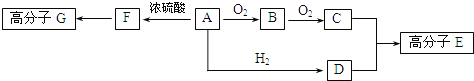
��ش��������⣺
(1)F�к��еĹ�������________��G�Ľṹ��ʽ___________��
(2)һ��������B����������Ӧ�Ļ�ѧ����ʽ__________��
(3)��C.D��һ�������·�Ӧ�������ɻ�״������仯ѧ��Ӧ����ʽΪ_________��
(4)A��ͬ���칹��ܶ࣬д����A�����������Ų�ͬ��������NaOH��Һ��Ӧ��2��ͬ���칹��Ľṹ��ʽ��_______________________��
���𰸡� ̼̼˫����ȩ�� ![]() OHC-CH2-CHO+4Ag��NH3��2OH
OHC-CH2-CHO+4Ag��NH3��2OH![]() 4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O HOCH2CH2CH2OH+HOOCCH2COOH
4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O HOCH2CH2CH2OH+HOOCCH2COOH![]()
![]() +2H2O CH3CH2COOH��CH3COOCH3
+2H2O CH3CH2COOH��CH3COOCH3
������������A��ֻ����C��H��O����Ԫ�أ�һ���������ܷ���������Ӧ����A�к�-CHO��A�ɷ�������������Ӧ����A�л���-OH����CӦΪ��Ԫ�ᣬC����Է�������Ϊ104��104-(45��2)=14��������1��CH2������AΪHOCH2CH2CHO��BΪOHC-CH2-CHO��CΪHOOC-CH2-COOH��DΪHOCH2CH2CH2OH��C��D�������۷�Ӧ���ɸ߷��ӣ�FΪCH2=CHCHO��F�����Ӿ۷�Ӧ���ɸ߷��ӡ�
(1)FΪCH2=CHCHO��������Ϊ̼̼˫����ȩ����F�����Ӿ۷�Ӧ����GΪ![]() ���ʴ�Ϊ��̼̼˫����ȩ����
���ʴ�Ϊ��̼̼˫����ȩ����![]() ��
��
(2)B����������Ӧ�Ļ�ѧ����ʽΪOHC-CH2-CHO+4Ag(NH3)2OH![]() 4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O���ʴ�Ϊ��OHC-CH2-CHO+4Ag(NH3)2OH
4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O���ʴ�Ϊ��OHC-CH2-CHO+4Ag(NH3)2OH![]() 4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O��
4Ag+NH4OOC-CH2-COONH4+6NH3+2H2O��
(3)C��D��һ�������·�Ӧ�������ɻ�״������Ļ�ѧ��Ӧ����ʽΪHOCH2CH2CH2OH+HOOCCH2COOH![]()
![]() +2H2O���ʴ�Ϊ��HOCH2CH2CH2OH+HOOCCH2COOH
+2H2O���ʴ�Ϊ��HOCH2CH2CH2OH+HOOCCH2COOH![]()
![]() +2H2O��
+2H2O��
(4)AΪHOCH2CH2CHO����A�����������Ų�ͬ��������NaOH��Һ��Ӧ��ͬ���칹��ΪCH3CH2COOH��CH3COOCH3��HCOOCH2CH3���ʴ�Ϊ��CH3CH2COOH��CH3COOCH3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ: MnO2 +4HCl��Ũ�� ![]() MnCl2 + Cl2��+ 2H2O����һ�������Ķ��������ܽ��ڹ�����Ũ�����У���Ӧһ��ʱ������ɱ�״��������4.48 L �����跴Ӧǰ����Һ������䣩���Իش��������⣺
MnCl2 + Cl2��+ 2H2O����һ�������Ķ��������ܽ��ڹ�����Ũ�����У���Ӧһ��ʱ������ɱ�״��������4.48 L �����跴Ӧǰ����Һ������䣩���Իش��������⣺
��1���õ����ŷ������÷�Ӧ�е���ת�Ƶķ������Ŀ��______
MnO2 +4HCl��Ũ�� ![]() MnCl2 + Cl2��+ 2H2O
MnCl2 + Cl2��+ 2H2O
��2�����㷴Ӧ���ĵ�MnO2������______ ��
��3�����㱻������HCl���ʵ���______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Է�������ΪM����̬������V L����״����������m g ˮ��(����ˮ��Ӧ)���õ���������Ϊw%����Һ�����ʵ���Ũ��Ϊcmol/L���ܶ�Ϊ�� g��cm��3��������˵����ȷ����
A. ��Һ�ܶ���= ![]() B. ��Է�������M=
B. ��Է�������M=![]()
C. ���ʵ���Ũ��c=![]() D. ���ʵ���������w%=
D. ���ʵ���������w%=![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һЩ��Ҫ�Ļ�ѧ����������˵����������ȷ����
��Fe(OH)3�����CuSO4��Һ���ǻ����
��BaSO4��һ��������ˮ��ǿ�����
�۱����ᡢ���С�մ�ֱ������ᡢ���
��ú�ĸ���ú��������Һ�������ڻ�ѧ�仯
���û���Ӧ���������ӷ�Ӧ
A. �٢ڢ� B. �٢ڢ� C. �ڢۢ� D. �ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ�����˵����ȷ����
A. SO2������ɱ��������
B. ����β���к��д���������Ⱦ��������Ͳ���ȫȼ����ɵ�
C. �������������Ԫ�أ�����Ҫ��Ը����{�����ʳ��
D. ��ˮ�����ķ�����Ҫ��������ⷨ�����ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨijͭ������ͭ�Ļ������ͭԪ�ص�����������ijͬѧ�������ͼ��ʾʵ��װ�á�
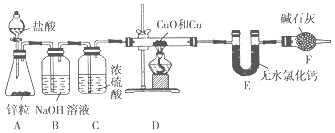
�ش��������⣺
��1��)װ��A��ʢװ���������������Ϊ____________��
��2��ʵ��ʱװ��A�пɹ۲쵽������________________________________________ ��������Ӧ�����ӷ���ʽΪ__________________________________________________��
��3��װ��B��������_______________________________________________________��
��4���ڼ���װ��D֮ǰ��Ӧ�ý��е�һ��������________________________________��Ŀ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ���ԭ�ϣ����ɶ���������Ʊ����ش��������⣺
��1�������飨C4H10��������1-��ϩ��C4H8�����Ȼ�ѧ����ʽ���£�
��C4H10(g)= C4H8(g)+H2(g) ��H1
��֪����C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ��H2=-119 kJ��mol-1
O2(g)= C4H8(g)+H2O(g) ��H2=-119 kJ��mol-1
��H2(g)+ ![]() O2(g)= H2O(g) ��H3=-242 kJ��mol-1
O2(g)= H2O(g) ��H3=-242 kJ��mol-1
��Ӧ�ٵĦ�H1Ϊ________ kJ��mol-1��ͼ��a���Ƿ�Ӧ��ƽ��ת�����뷴Ӧ�¶ȼ�ѹǿ�Ĺ�ϵͼ��x_____________0.1������ڡ���С�ڡ�������ʹ��ϩ��ƽ�������ߣ�Ӧ��ȡ�Ĵ�ʩ��__________�����ţ���
A�������¶� B�������¶� C������ѹǿ D������ѹǿ

��2������������Ļ��������һ������ͨ������д����ķ�Ӧ���������������ǻ���������������к��ж�ϩ�����顢�����ȡ�ͼ��b��Ϊ��ϩ�������������n��������/n�����飩�Ĺ�ϵ��ͼ�����߳��������ߺ͵ı仯���ƣ��併�͵�ԭ����___________��
��3��ͼ��c��Ϊ��Ӧ���ʺͷ�Ӧ�¶ȵĹ�ϵ���ߣ���������Ҫ�Ǹ����ѽ����ɵĶ�̼����������ϩ������590��֮ǰ���¶����߶������ԭ�������___________��____________��590��֮��ϩ���ʿ��ٽ��͵���Ҫԭ�������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ϊ2l���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺ͢ڣ���CH4��H2OΪԭ�����Ʊ��״���
�� CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ��H1
CO(g)+3H2(g) ��H1
�� CO(g)+2H2(g) ![]() CH3OH(g) ��H2
CH3OH(g) ��H2
��0.20mol CH4��0.30 mol H2O(g)ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��

��1����֪��P1��100��ʱ�ﵽƽ�������ʱ��Ϊ5min������CH4��ʾ��ƽ����Ӧ����Ϊ______��
��2����Ӧ�ٵġ�H1____0��ͼ�е�P1______P2���<������=����>������
��3����ѹǿΪ0.1MPa�����£���һ����CO��H2�Ļ�������ڴ������������Է���Ӧ���ɼ״�����Ӧ�ڵġ�H2____0����S____0���<������=����>������
��4���������и��������ݣ����㷴Ӧ����100��ʱ��ƽ�ⳣ��ֵ____________��д��������̼������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com