
【题目】(1)用双线桥法表示反应中电子转移的方向和数目CuO+H2![]() Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
(2)用双线桥法表示反应中电子转移的方向和数目2Na+Cl2![]() 2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
(3)配平下列氧化还原反应方程式:
①____HNO3![]() ____H2O+____NO2↑+____O2↑;
____H2O+____NO2↑+____O2↑;
②____Cl2+____KOH=____KCl+____KClO3+____H2O。
【答案】 H 失去 Cu 得到
H 失去 Cu 得到 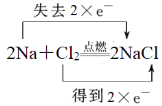 降低 还原 升高 氧化 4HNO3
降低 还原 升高 氧化 4HNO3![]() 2H2O+4NO2↑+O2↑ 3Cl2+6KOH=5KCl+KClO3+3H2O
2H2O+4NO2↑+O2↑ 3Cl2+6KOH=5KCl+KClO3+3H2O
【解析】
双线桥法表示元素的原子在化学反应前后电子的得失和数目,结合反应中元素的化合价变化情况、氧化还原反应的有关概念结合电子得失守恒和原子守恒分析解答。
(1)反应中铜元素化合价从+2价降低到0价,得到2个电子,被还原,发生还原反应;氢元素化合价从0价升高到+1价,失去1个电子,被氧化,发生氧化反应,根据电子得失守恒可知反应中转移2个电子,则用双线桥法表示反应中电子转移的方向和数目为 ,故答案为:
,故答案为: ;H;失去;Cu;得到;
;H;失去;Cu;得到;
(2)反应中氯元素化合价从0价降低到-1价,得到1个电子,被还原,发生还原反应;钠元素化合价从0价升高到+1价,失去1个电子,被氧化,发生氧化反应,根据电子得失守恒可知反应中转移2个电子,则用双线桥法表示反应中电子转移的方向和数目为 ,故答案为:
,故答案为: ;降低;还原;升高;氧化;
;降低;还原;升高;氧化;
(3)①反应中氮元素化合价从+5价降低到+4价,得到1个电子,氧元素化合价从-2价升高到0价,失去2个电子,则根据电子得失守恒和原子守恒可知反应的方程式为4HNO3![]() 2H2O+4NO2↑+O2↑;
2H2O+4NO2↑+O2↑;
②反应中氯元素化合价部分从0价升高到+5价,部分降低到-1价,则根据得失电子守恒和原子守恒可知反应的方程式为3Cl2+6KOH=5KCl+KClO3+3H2O。


科目:高中化学 来源: 题型:
【题目】根据转化关系判断下列说法正确的是
![]()
A. 反应①中,(C6H10O5)n可表示淀粉或纤维素
B. 反应②中,1mol葡萄糖可分解产生3mol乙醇
C. 将在空气中灼烧后的铜丝趁热插入乙醇中可得到乙酸
D. 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应: COS(g)+ H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
己知: 2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
写出表示CO燃烧热的热化学方程式:_______________。
(2)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11;草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-5; 0.1mol/LNa2CO3溶液的pH_____0.1mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)。若将等分浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是___________。(选填编号)
A.c(H+)>c(HC2O4-)> (HCO3-)>c (CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(3)已知:①难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10;②25℃时2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体长变化),得到c(HF)、c(F-) 与溶液pH 的变化关系,如图所示:
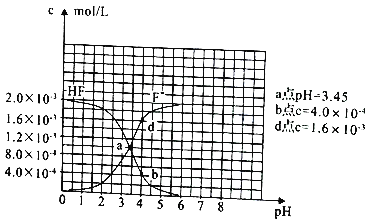
请根据信息回答下列问题:
①25℃时,HF电离平衡常数的数值Ka≈_______。
②4.0×10-3mol/LHF溶液与4.0×10-4mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Mg、Al各0.1mol,分别投入到盛有100mL 0.5mol/L盐酸中,充分反应后产生的氢气
A. Na最多 B. Mg最多 C. Al最多 D. 一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属的混合物共15g,跟足量的盐酸反应时,恰好得到11.2L氢气(标况)。下列各组金属不可能构成上述条件的混合物的是
A. 镁和银 B. 铜和锌 C. 铝和铁 D. 镁和铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com