
二氧化碳和纳在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石)。设NA为阿伏加德罗常数的值,下列有关此反应的叙述中,不正确的是
| A.1molC(金刚石)中含有C—C键数目为2NA |
| B.当有0.4molNa参与反应时,被还原的CO2为0.3NA |
| C.金刚石与石墨互为同素异形体 |
| D.X的化学式为Na2CO3 |
B
解析试题分析:A、金刚石中每个C原子形成4个C-C,每个C-C键含有1对共用电子对。碳原子的价电子是4个,所以平均每个碳原子形成4÷2=2个C-C键,因此1mol金刚石中含有C-C键为2mol,故含有C-C数目为2mol×NAmol-1=2NA,故A正确;B、根据由原子守恒可知,X为Na2CO3。在反应中碳原子的化合价从+4价降低到0价,得到4个电子。钠元素的化合价从0价升高到+1价,失去1个电子。所以根据电子得失守恒可知,当有0.4molNa参与反应时,故被还原的二氧化碳为0.4mol÷4=0.1mol,其个数是0.1mol×NAmol-1=0.1NA,故B错误;C、金刚石与石墨都是碳元素组成的结构不同的单质,互为同素异形体,故C正确;D、反应前有3个C原子,6个O原子,4个Na原子,反应后除2X外,还有1个C原子,因此根据原子守恒可推断出2X由4个Na原子,2个C原子,6个O原子组成,则1个X组成为:2个Na原子,1个C原子,3个O原子,由此可推断出X的化学式为:Na2CO3,故D正确,答案选B。
考点:考查质量守恒定律、氧化还原反应、同素异形体、物质结构的有关判断与计算等


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:单选题
下列关于晶体的说法一定正确的是( )
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为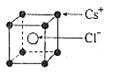
A.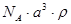 | B. | C.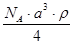 | D.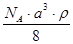 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中正确的是
| A.晶体与非晶体的根本区别在于是否具有规则的几何外形 |
| B.晶体具有物理性质各向异性 |
| C.晶体、非晶体均具有固定的熔点 |
| D.由玻璃制成规则的玻璃球体现了晶体的自范性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面有关晶体的叙述中,错误的是( )
| A.金刚石网状结构中,碳原子和共价键的个数比为1:2 |
| B.氯化钠晶体中,每个Na+周围距离相等的Cl-肯定为6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻6个Cs+ |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
形成物质世界多样性的原因有:( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
| A.仅①②③ | B.仅②④⑤ |
| C.仅①③ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰-Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围____________个水分子以氢键结合,晶体中,1 mol水可形成________ mol氢键。
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在298K、100kPa时,已知: ①2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.Δ H3=ΔH1+2ΔH2 | B.Δ H3=ΔH1+ΔH2 |
| C.Δ H3=ΔH1-2ΔH2 | D.Δ H3=ΔH1-ΔH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表是某些原子晶体的熔点和硬度
| 原子晶体 | 金刚石 | 氮化硼 | 碳化硅 | 石英 | 硅 | 锗 |
| 熔点/℃ | 3 900 | 3 000 | 2 700 | 1 710 | 1 410 | 1 211 |
| 硬度 | 10 | 9.5 | 9.5 | 7 | 6.5 | 6.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com