
【题目】对于可逆反应 N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是
2NH3(g) ΔH<0,下列研究目的和示意图相符的是
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对平衡转化率的影响 | 平衡体系增加 N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
【答案】C
【解析】
A.合成氨反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响分析;
B.合成氨的反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C.利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析;
D.利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析。
A.该反应的正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,A错误;
B.因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,B错误;
C.反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,C正确;
D.因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,D错误;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
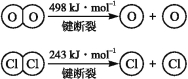
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识。下列说法错误的是 ( )
A.《梦溪笔谈![]() 器用》中“古人以剂钢为刃,柔铁为茎干,不尔则多断折”的“剂钢”是指铁的合金
器用》中“古人以剂钢为刃,柔铁为茎干,不尔则多断折”的“剂钢”是指铁的合金
B.《咏煤炭》(明![]() 于谦)中“凿开混沌得乌金……不辞辛苦出山林”其中“乌金”的主要成分是煤炭
于谦)中“凿开混沌得乌金……不辞辛苦出山林”其中“乌金”的主要成分是煤炭
C.《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质……”文中的“裘”主要成分是蛋白质
D.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列叙述错误的是![]()
![]()
A.BaCO3在医学上可用作钡餐
B.手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料
C.“地沟油”禁止食用,但可用来制取肥皂
D.工业上生产玻璃、水泥、漂白粉,均需要用石灰石为原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+ CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
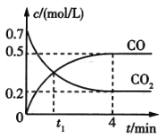
(1)t1min时,正、逆反应速率的大小关系为v正__v逆(填“>”“<”或“=”).
(2)0~4min内,CO2的转化率为__,CO的平均反应速率,v(CO)=__。
(3)下列条件的改变能减慢上述反应的反应速率的是__(填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是__。
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据
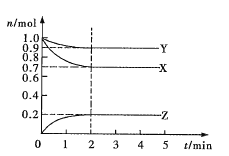
(1)该反应的化学方程式为______________。
(2)反应开始至2min,用Z表示的平均反应速率为_________。
(3)下列叙述能说明上述反应达到化学平衡状态的是________(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗![]() X,同时生成
X,同时生成![]() Z
Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
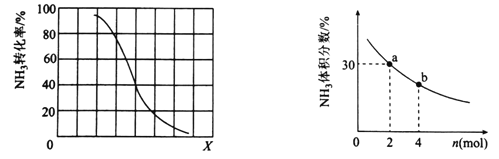
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
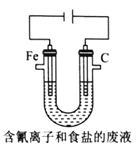
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于1L的密闭容器中,混合后发生如下反应:![]() 。若经2s后测得C的浓度为1.2mol/L,则下列说法正确的是( )
。若经2s后测得C的浓度为1.2mol/L,则下列说法正确的是( )
A.用物质A表示的反应速率为![]()
B.用物质B表示的反应速率为![]()
C.2s内物质A的转化率为30%
D.2s时物质B的浓度为0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列关于该有机物的描述不正确的是
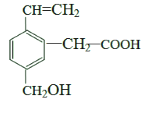
①所有碳原子可能共面;
②能使酸性KMnO4溶液和溴水褪色,且原理相同;
③1mol该有机物分别与足量Na或NaHCO3反应,产生气体在相同条件下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol该有机物完全燃烧生成CO2和H2O消耗O2的体积为280 L(标准状况)
A. ①②B. ②⑥C. ③⑥D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com