
����Ŀ��ij��Һ�п��ܺ���OH-��CO32-��[Al(OH)4]-��SiO32-��SO42-��Na+��Fe3+��Mg2+��Al3+�����ӡ��������Һ����μ���һ�����ʵ���Ũ�ȵ�����ʱ���������ɳ��������ʵ�����������Һ������仯��ͼ��ʾ������˵����ȷ����
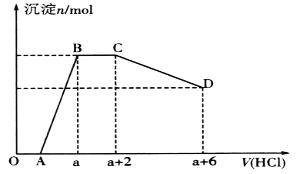
A. BC����OH-�����ᷴӦ
B. ��Ӧ��������Һ�е�����ֻ��NaC1
C. ԭ��Һ�к���CO32-��[Al(OH)4]-�����ʵ���֮��Ϊ3��4
D. ԭ��Һ��һ�����е�������Na+��OH-��SiO32-��SO42-��[A1(OH)4]-��CO32-
���𰸡�C
��������
��ͼ���֪����ʼ����HClʱ�������ɣ�˵�������HCl����Һ��OH-�ķ�Ӧ������Һ��һ��������������������ӷ�����Ӧ������:Fe3+��Mg2+��Al3+;֮��ʼ���ɳ����ҷ�Ӧ���ɳ���������˵����Һ�д���AlO2-��SiO32-����������������������䣬�������������ֻ����CO32-���ӣ�̼������ӷ�Ӧ�������������ᣬ������С�������ٸı䣬��һ��֤��������������������������������������������ᣬ���ʣ�����Ϊ����;��������Ӳ���ȷ�����ڣ���������Һ�ĵ����Կ�֪����Һ�����ٺ���K+��Na+�����е�һ��������
BC����CO32-�����ᷴӦ����A��������Һ�����ٺ���K+��Na+�����е�һ�����ӡ���Ӧ��������Һ��һ�������ӡ������ӡ������ӻ�����ӣ���B������
����ͼ���֪��̼������ӷ�Ӧ������Ϊ2�������Ӧ�ܷ���ʽΪ:CO32-+2H+=CO2��+H2O;���������ܽ����ĵ��������Ϊ4�������Ӧ�����ӷ���ʽΪ:Al(OH)3+3H+=Al3++3H2O;����ԭ��Һ�к���CO32-��Al(OH)3�����ʵ���֮��Ϊn(CO32-):n(Al(OH)3)=2��![]() ��
��![]() =3:4����C��ȷ���������Ϸ�����֪��ԭ��Һ��һ�����е�������:OH-��SiO32-��[A1(OH)4]-��CO32-����D����
=3:4����C��ȷ���������Ϸ�����֪��ԭ��Һ��һ�����е�������:OH-��SiO32-��[A1(OH)4]-��CO32-����D����


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij����FeCl2��FeCl3��CuCl2�Ĺ�ҵ��Һ�л���ͭ���Ʊ��Ȼ���������������£�������˵����ȷ����
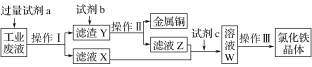
A. �Լ�a�������Լ�b��ϡ����
B. ������������������������ͬ
C. �Լ�c����������Ӧ�ķ�ӦΪ�� 2Fe2����Cl2===2Cl����2Fe3��
D. ������KMnO4��Һ�ɼ�����ҺW���Ƿ���Fe2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ļ�����������ʵ�飺

��1������X��������___________��
��2������A��___________��
��3����������NaOH ��Һʱ������Ӧ�����ӷ���ʽΪ______________���������ᷢ����Ӧ�����ӷ���ʽΪ_______________��
��4����ҺB �������ӳ�OH-���_________����ҺD�д��ڵĽ�������Ϊ___________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������滮��ʵʩ�������Ϻ��Ļ���������λ�ڹ滮����һ������������Ǩ�����������ܵ��ó��������غ�ɫ���������š��������һ������Ⱦ����ܺ��У� ��
A. FeO�۳� B. P2O5�۳� C. Fe2O3�۳� D. SiO2�۳�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ͬѧ������ʵ��̽�������ʡ��ش��������⣺
(1)���Թ��м��������̷���Ʒ����ˮ�ܽ⣬���Ƴ�FeSO4��Һ������Һ�������������м����Ŀ����_____��
(2)����ͬѧȡ2 mLFeSO4��Һ�����뼸����ˮ���ټ���1��KSCN��Һ����Һ��죬˵��Cl2�ɽ�Fe2+������FeSO4��Һ����ˮ��Ӧ�����ӷ���ʽΪ______��
(3)����ͬѧ��Ϊ�����ʵ�鲻���Ͻ�������ͬѧ��2 mLFeSO4��Һ���ȼ���0.5 mL ú�ͣ�����Һ�������μ��뼸����ˮ��1��KSCN��Һ����Һ��죬ú�͵�������_________��
(4)����ͬѧ��ʢ��H2O2��Һ���Թ��м��뼸���ữ��FeSO4��Һ����Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪ________________
(5)Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ������˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣
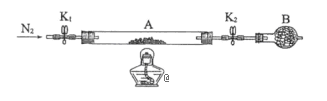
������B��������______��
�ڽ�����ʵ�����������ȷ����_____�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
a����ȼ�ƾ��ƣ����� b��Ϩ��ƾ��� c���ر�K1��K2
d����K1��K2������ͨ��N2 e������A f����ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=_________����ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx_______���ƫ��ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�
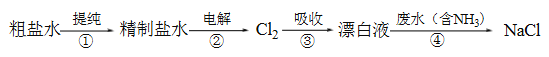
���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩֱ��ˮ�Ϸ����Ҵ�����ȾС��Ӧ���ڹ�ҵ�ϳɣ������й�˵���������(����)
A. �÷�Ӧ���ڼӳɷ�Ӧ
B. ��ϩ��ʹ����KMnO4��Һ��ɫ
C. �����к���������ϩ������H2��ȥ
D. �����ʵ�������ϩ���Ҵ����ȼ�գ���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ijŨ��H3PO4��Һ����μ���NaOH��Һ���μӹ����и��ֺ����������ʵ�������������ҺpH�ı仯��������ͼ��ʾ������˵����ȷ���ǣ�
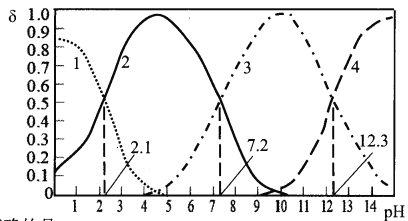
A. ����1������2�ֱ��ʾ8(H3PO4)��6(HPO42-)�ı仯
B. 25��ʱ��H3PO4�ĵ��볣��K1=10-2.1
C. pH=7.2ʱ����Һ��c(H2PO4��)+c(HPO42-)+c(OH��)=c(Na+)+c(H+)
D. pH=12.3ʱ����Һ����ˮ�������c(H+)=10-12.3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��һ����Ҫ�Ļ���ԭ�ϣ���������������Ӧ��ʮ�ֹ㷺��
(1)Cl2����NaOH��Һ��Ӧ��ȡ����Һ����д������Һ����Ч�ɷֵĵ���ʽ__________��
(2)ʵ���ҿ���MnO2��Ũ���ᷴӦ��ȡCl2����Ӧ�Ļ�ѧ����ʽ��____________________��
(3)��ҵ�Ͽɲ�ȡ��ⱥ��ʳ��ˮ�ķ�����ȡCl2�������ĵ缫��ӦʽΪ________________��
(4)��HClΪԭ�ϣ���O2������ȡCl2�������Ч�棬������Ⱦ����Ӧ���£�4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H =��115.4 kJmol-1������Ӧ��ͬһ��Ӧ���У�ͨ�����ƺ���������������ѭ�����У���ʹHClת���ʽӽ�100%�������ԭ������ͼ��ʾ��
2Cl2(g) + 2H2O(g) H =��115.4 kJmol-1������Ӧ��ͬһ��Ӧ���У�ͨ�����ƺ���������������ѭ�����У���ʹHClת���ʽӽ�100%�������ԭ������ͼ��ʾ��
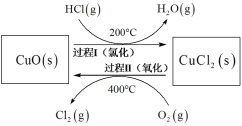
����I�ķ�ӦΪ��2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =��120.4 kJmol-1
CuCl2(s) + H2O(g) H1 =��120.4 kJmol-1
�ٹ���II��Ӧ���Ȼ�ѧ����ʽΪ_______��
�ڹ���I����������ͨ��ϡNaOH��Һ����������̪�����м�⣬�Ȼ�������ҪΪ����HCl�����壬�ж��Ȼ�����ʱ��Һ������Ϊ_______��
����ͬ�����£������Ȼ��¶����ߵ�300�棬��Һ�г������������ʱ�佫���̣���ԭ��Ϊ_______��
��ʵ�����ڲ�ͬѹǿ�£��ܷ�Ӧ��HClƽ��ת���ʣ���HCl�����¶ȱ仯��������ͼ��
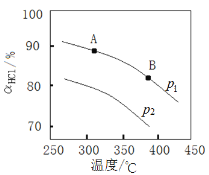
����ƽ�ⳣ���Ƚϣ�K(A)_____K(B) ���������������������ͬ����
����ѹǿ�Ƚϣ�p1_____ p2��
(5)����������ȡCl2��ԭ�����乲֮ͬ����_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com