
【题目】世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验所述的变化过程与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH 溶液滴入FeSO4 溶液中 | 石蕊溶液滴入氯水中 | 向 K2Cr2O7 溶液 中滴加浓硫酸 | CO2 通入 Na2O2 |
现象 | 产生白色沉淀,最 终变为红褐色 | 溶液变红,随后迅速褪色 | 溶液黄色变浅, 橙色加深 | 固体逐渐变白 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中大量共存的一组离子是( )
A.Cu2+、SO42-、OH-、K+B.Fe3+、NO3-、Cl-、H+
C.K+、CO32-、Cl-、H+D.H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以含钴废催化剂(含Co、Fe、FeO、Fe2O3以及不溶于酸的杂质)制备氯化钴晶体与黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:
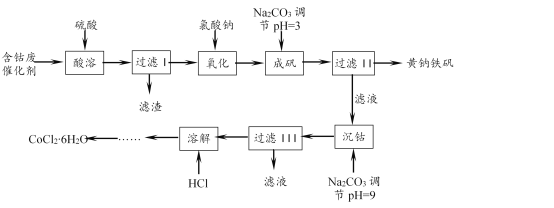
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
(1)“氧化”“成矾”需在加热条件下进行。“氧化”时反应的离子方程式为____。实验中能否选用KMnO4溶液检验Fe2+是否完全氧化,____(填“能”或“不能”),理由是____。
(2)该条件下,若用H2O2作氧化剂,实际H2O2的用量比理论用量要多,重要原因之一是H2O2发生了分解。该条件下H2O2分解较快的原因是:① ____;②____。
(3)成矾过程中反应的离子方程式为____。检验成矾是否完全的实验操作是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
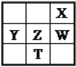
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙、丁、戊五种短周期元素,原子序数依次增大,其常见化合价依次为+1、-2、+1、+3、-1。它们形成的物质间的转化关系如下图所示。常温下用惰性电极电解(有阳离子交换膜)1L l mol/L的A溶液。
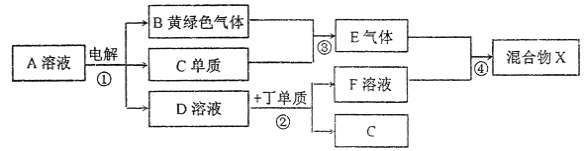
请按要求回答下列问题:
(1)己元素与丙元素同主族,比丙原子多2个电子层,则己的原予序数为______;推测相同条件下丙、己单质分别与水反应剧烈程度的依据是_________。
(2)甲、乙、戊按原予个数比1:1:1形成的化合物Y具有漂白性,其电子式为______。
(3)上图转化关系中不属于氧化还原反应的有(填编号)______。
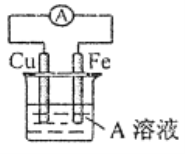
(4)接通如图电路片刻后,向烧杯中滴加一种试剂即可检验铁电极被腐蚀,此反应的离子方程式为___________。
(5)写出反应③的化学方程式_________;反应②的离子方程式为___________。
(6)若上图中各步反应均为恰好完全转化,则混合物X中含有的物质(除水外)有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
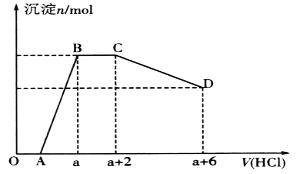
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
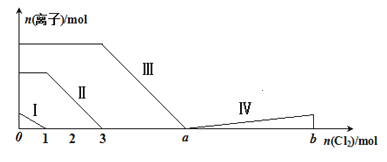
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
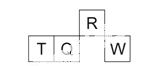
A. 最简单气态氢化物的热稳定性:R > Q
B. 最高价氧化物对应水化物的酸性:Q < W
C. 原子半径:T > Q > R
D. 含 T 的盐溶液一定显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com