
����Ŀ���мס��ҡ��������������ֶ�����Ԫ�أ�ԭ���������������䳣�����ϼ�����Ϊ+1��-2��+1��+3��-1�������γɵ����ʼ��ת����ϵ����ͼ��ʾ���������ö��Ե缫��⣨�������ӽ���Ĥ��1L l mol/L��A��Һ��
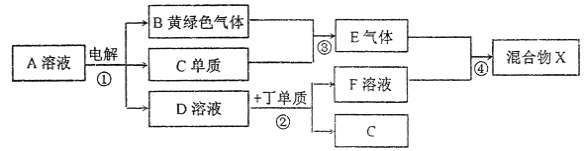
�밴Ҫ��ش��������⣺
��1����Ԫ�����Ԫ��ͬ���壬�ȱ�ԭ�Ӷ�2�����Ӳ㣬��ԭ������Ϊ______���Ʋ���ͬ�����±��������ʷֱ���ˮ��Ӧ���ҳ̶ȵ�������_________��
��2���ס��ҡ��찴ԭ�������1��1��1�γɵĻ�����Y����Ư���ԣ������ʽΪ______��
��3����ͼת����ϵ�в�����������ԭ��Ӧ���У����ţ�______��
��4����ͨ��ͼ��·Ƭ�̺����ձ��еμ�һ���Լ����ɼ������缫����ʴ���˷�Ӧ�����ӷ���ʽΪ___________��
��5��д����Ӧ�۵Ļ�ѧ����ʽ_________����Ӧ�ڵ����ӷ���ʽΪ___________��
��6������ͼ�и�����Ӧ��Ϊǡ����ȫת����������X�к��е����ʣ���ˮ�⣩��___________��
���𰸡�37 ͬ����Ԫ�صĽ�������˵���������Ӷ���ǿ���Ʋ⼺������ˮ��Ӧ�ϱ������� ![]() �� 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2�� Cl2 + H2
�� 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2�� Cl2 + H2![]() 2HCl 2A1+2OH-+2H2O=2AlO2-+3H2�� Al(OH)3��NaCl
2HCl 2A1+2OH-+2H2O=2AlO2-+3H2�� Al(OH)3��NaCl
��������
���A����Һ�õ��������ʣ�����ʺ�ˮ�ŵ磬�õ��Ļ���ɫ����BΪCl2������CΪH2�����߷�Ӧ����EΪHCl��DΪ�������+3�ۣ�������D��Һ��Ӧ������������ΪAl��DΪNaOH��FΪNaAlO2��AΪNaCl����ⷴӦΪ2NaCl+2H2O![]() 2NaOH+H2��+Cl2������2Al��2NaOH��2NaAlO2���õ�ƫ��������HCl���ʵ���֮��Ϊ1��1����H2O+HCl+NaAlO2�TNaCl+Al(OH)3������X�к��е�����ΪAl(OH)3��H2O��NaCl�����Ԫ�ػ��ϼ���ԭ��������֪����ΪHԪ�أ���ΪOԪ�أ���ΪNa����ΪAl����ΪCl��
2NaOH+H2��+Cl2������2Al��2NaOH��2NaAlO2���õ�ƫ��������HCl���ʵ���֮��Ϊ1��1����H2O+HCl+NaAlO2�TNaCl+Al(OH)3������X�к��е�����ΪAl(OH)3��H2O��NaCl�����Ԫ�ػ��ϼ���ԭ��������֪����ΪHԪ�أ���ΪOԪ�أ���ΪNa����ΪAl����ΪCl��
���A����Һ�õ��������ʣ�����ʼ�ˮ�Էŵ磬�õ�����ɫ����BΪCl2������CΪH2�����߷�Ӧ����EΪHCl��DΪ�������+3�ۣ�������D��Һ��Ӧ������������ΪAl��DΪNaOH��FΪNaAlO2��AΪNaCl����ⷴӦΪ2NaCl+2H2O![]() 2NaOH+H2��+Cl2������2Al��2NaOH��2NaAlO2���õ�ƫ��������HCl���ʵ���֮��Ϊ1��1����H2O+HCl+NaAlO2�TNaCl+Al (OH)3������X�к��е�����ΪAl (OH)3��H2O��NaCl�����Ԫ�ػ��ϼ���ԭ��������֪����ΪHԪ�أ���ΪOԪ�أ���ΪNa����ΪAl����ΪCl��
2NaOH+H2��+Cl2������2Al��2NaOH��2NaAlO2���õ�ƫ��������HCl���ʵ���֮��Ϊ1��1����H2O+HCl+NaAlO2�TNaCl+Al (OH)3������X�к��е�����ΪAl (OH)3��H2O��NaCl�����Ԫ�ػ��ϼ���ԭ��������֪����ΪHԪ�أ���ΪOԪ�أ���ΪNa����ΪAl����ΪCl��
(1)��Ԫ�����(Na)Ԫ��ͬ���壬�ȱ�ԭ�Ӷ�2�����Ӳ㣬��ԭ������Ϊ11+8+18=37��ͬ����Ԫ�صĽ�������˵���������Ӷ���ǿ���Ʋ⼺������ˮ��Ӧ�ϱ������ң�
(2)�ס��ҡ��찴ԭ�������1:1:1�γɵĻ�����Y����Ư���ԣ�YΪHClO�������ʽΪ��![]() ��
��
(3)��ͼת����ϵ�У���Ӧ�٢ڢ�����������ԭ��Ӧ����Ӧ�ܲ�����������ԭ��Ӧ��
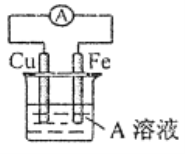
(4)��ͨ��·Ƭ�̺�FeΪ�������������ҺΪ�Ȼ�����Һ������������ʴ����Fe2+���ӣ���K3[Fe(CN)6]���飬����Fe2+�����ӷ���ʽΪ��3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2����
(5)��Ӧ��Ϊ������������ȼ�գ�������Ӧ�Ļ�ѧ����ʽΪCl2 + H2![]() 2HCl��
2HCl��
��Ӧ��ΪAl����NaOH��Һ���������ķ�Ӧ�����ӷ���ʽΪ��2A1+2OH-+2H2O=2AlO2-+3H2����
(6)�ɷ���֪��X�г�ˮ�⺬�е�����ΪAl(OH)3��NaCl��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���Ȼ��������һ������Լ����Ǽ����ڴ��������������£�һ����Ч������ϩ�������Ȼ�����Ʒ���Լ���Ϊԭ�Ϻϳɲ��ֻ�����Ʒ��������(���ַ�Ӧ��������ȥ):

(1)A��C���������������ŵ����Ʒֱ�Ϊ__________��__________��
(2)д��A��ͬ���칹��Ľṹ��ʽ:___________________��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ�ͷ�Ӧ���͡�
��Ӧ��:________________________________________����Ӧ����:_____________��
��Ӧ�ڣ�________________________________________����Ӧ����: _____________��
��Ӧ��: ________________________________________����Ӧ����:_____________��
(4)��ͼΪʵ������ȡD��װ��ͼ��

��ͼ���Թܼ��е��Լ�����Ϊ______________����������____________________________���û�ѧ����ʽ��ʾ�����Լ�����Ļ�ѧ��Ӧ:_______________________________________��
��ʵ�������ӻ�����з����D�ķ���Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����8�����ʣ������飻����ϩ������Ȳ���ܱ����ݼױ����������飻�߾۱�ϩ�����ϩ�����мȲ���ʹ����KMnO4��Һ��ɫ��Ҳ����ʹ���CCl4��Һ��ɫ���ǣ� ��
A.�٢ڢۢ�B.�ܢޢߢ�C.�٢ܢޢ�D.�ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹ��˵������ȷ���ǣ� ��
A.���Ƿǽ���Ԫ�أ������ĵ����ǻҺ�ɫ�н�������Ĺ���
B.��ĵ������ܽ��ڽ����;�Ե��֮�䣬�����õİ뵼�����
C.��Ļ�ѧ���ʲ����ã������²����κ�������Ӧ
D.�����ȵ�һ���¶�ʱ�������������������ȷǽ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������滮��ʵʩ�������Ϻ��Ļ���������λ�ڹ滮����һ������������Ǩ�����������ܵ��ó��������غ�ɫ���������š��������һ������Ⱦ����ܺ��У� ��
A. FeO�۳� B. P2O5�۳� C. Fe2O3�۳� D. SiO2�۳�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����ʵ���֮��Ϊ2��1��SO2��O2�Ļ���������ݻ�Ϊ2 L�ĺ����ܱ������з�����Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)(����ӦΪ���ȷ�Ӧ)��n(SO2)��ʱ��仯��ϵ���±���
2SO3(g)(����ӦΪ���ȷ�Ӧ)��n(SO2)��ʱ��仯��ϵ���±���
ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
����˵����ȷ����( )
A. ��������������ܶȲ���ʱ���÷�Ӧ�ﵽƽ��״̬
B. �÷�Ӧ���е���3����ʱ���淴Ӧ����С������Ӧ����
C. �ӷ�Ӧ��ʼ���ﵽƽ�⣬��SO3��ʾ��ƽ����Ӧ����Ϊ0.01 mol/(L��min)
D. �����ڴﵽƽ��״̬ʱ��ѹǿ����ʼʱ��ѹǿ֮��Ϊ5��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�
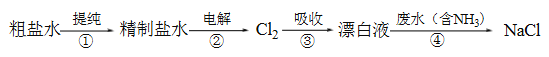
���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.100 mol��L-1 AgNO3�ζ�50.0 mL 0.0500 mol��L-1 Cl-��Һ�ĵζ�������ͼ��ʾ�������й������������

A. �����������ݼ����֪Ksp(AgCl)��������Ϊ10-10
B. �����ϸ������Һ�����ϵʽc(Ag+)��c(Cl-)=Ksp(AgCl)
C. ��ͬʵ�������£�����Ϊ0.0400 mol��L-1 Cl-����Ӧ�յ�c�Ƶ�a
D. ��ͬʵ�������£�����Ϊ0.0500 mol��L-1 Br-����Ӧ�յ�c��b�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ݵ��������Ũ�ȣ�pH��ͬ��FeSO4��Һ����μ���NaClO��Һ��ʵ������ҺpH�����NaClO��Һ����仯��������ͼ��ʵ���������±�������˵������ȷ����
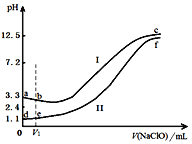
ʵ�� | ʵ������ |
�� | ����V1mL NaClO��Һ�����������ɫ���� |
�� | ����V1mL NaClO��Һ����Һ��ƣ�δ�������������μӳ��ֺ��ɫ���� |
A. a~b����Ҫ��Ӧ�����ӷ���ʽΪ��2Fe2+ + ClO��+5H2O===2Fe(OH)3��+Cl��+4H+
B. d~e����Ҫ��Ӧ�����ӷ���ʽΪ��2Fe2++2ClO��+3H+=== HClO + Cl��+ 2Fe3+ + H2O
C. c��f��pH�ӽ�����Ҫԭ���ǣ�ClO��+ H2O![]() HClO + OH��
HClO + OH��
D. ��c����Һ�м��������Ũ���ᣬ�����ܽⲢ�д̼�����ζ������ų�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com