
【题目】下列实验所述的变化过程与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH 溶液滴入FeSO4 溶液中 | 石蕊溶液滴入氯水中 | 向 K2Cr2O7 溶液 中滴加浓硫酸 | CO2 通入 Na2O2 |
现象 | 产生白色沉淀,最 终变为红褐色 | 溶液变红,随后迅速褪色 | 溶液黄色变浅, 橙色加深 | 固体逐渐变白 |
A. A B. B C. C D. D
【答案】C
【解析】
白色氢氧化亚铁被氧化为红褐色氢氧化铁;次氯酸具有氧化性,使石蕊褪色;K2Cr2O7溶液中存在Cr2O72-(橙色)+ H2O![]() 2H++2CrO42-(黄色),滴加浓硫酸,平衡逆向移动;2Na2O2+2CO2=2Na2CO3+O2,属于氧化还原反应。
2H++2CrO42-(黄色),滴加浓硫酸,平衡逆向移动;2Na2O2+2CO2=2Na2CO3+O2,属于氧化还原反应。
NaOH 溶液滴入FeSO4 溶液中,生成的白色氢氧化亚铁被氧化为红褐色氢氧化铁,与氧化还原反应有关,故不选A;次氯酸具有氧化性,使石蕊褪色,与氧化还原反应有关,故不选B;K2Cr2O7溶液中存在Cr2O72-(橙色)+ H2O![]() 2H++2CrO42-(黄色),滴加浓硫酸,平衡逆向移动,溶液黄色变浅,橙色加深,与氧化还原反应无关,故选C;2Na2O2+2CO2=2Na2CO3+O2,属于氧化还原反应,与氧化还原反应有关,故不选D。
2H++2CrO42-(黄色),滴加浓硫酸,平衡逆向移动,溶液黄色变浅,橙色加深,与氧化还原反应无关,故选C;2Na2O2+2CO2=2Na2CO3+O2,属于氧化还原反应,与氧化还原反应有关,故不选D。


科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
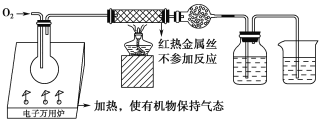
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是:________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为_____________________。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写在下表中:
物质种类 | 实例(写结构简式) |
_________ | _________ |
_________ | _________ |
_________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
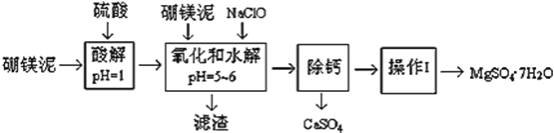
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_____________________________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):

(1)A、C分子中所含官能团的名称分别为__________、__________。
(2)写出A的同分异构体的结构简式:___________________。
(3)写出下列反应的化学方程式和反应类型。
反应①:________________________________________,反应类型:_____________;
反应②:________________________________________,反应类型: _____________;
反应③: ________________________________________,反应类型:_____________。
(4)下图为实验室制取D的装置图。

①图中试管甲中的试剂名称为______________,其作用是____________________________。用化学方程式表示甲中试剂参与的化学反应:_______________________________________。
②实验结束后从混合物中分离出D的方法为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:则下列说法正确的是
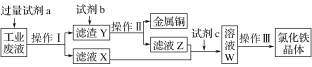
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为: 2Fe2++Cl2===2Cl-+2Fe3+
D. 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:
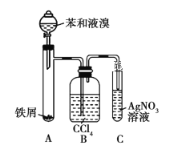
(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com