
����Ŀ����ͼ��ʾ����ȡ�屽��װ�á��ش���������:
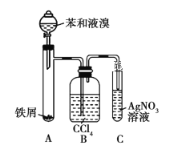
(1)װ��A�з�����Ӧ�Ļ�ѧ����ʽ��______________��______________��
(2)װ��C�й۲쵽��������______________��֤��____________��
(3)װ��B������ƿ��ƿ��ʢ��CCl4��ʵ���й۲쵽��������_________________��ԭ����___________________�����û��װ��B����װ��A��Cֱ�������������ʵ��װ��_________(����������������������)��ԭ����___________��
(4)ʵ����Ϻ�װ��A�Թ��е�Һ�嵹��ʢ����ˮ���ձ��У��ձ�_______(����������������)��Ϊ�屽��
���𰸡�2Fe+3Br2= 2FeBr3 ![]() +Br2
+Br2![]()
![]() +HBr ���ܿ��а������֣��Թ����е���ɫ�������� ��HBr���� Һ��ʳȺ�ɫ ��Ӧ���ȣ�װ��A�е��������ݳ�������CCl4�� ������ �ݳ���������Ҳ����AgNO3��Һ��Ӧ ��
+HBr ���ܿ��а������֣��Թ����е���ɫ�������� ��HBr���� Һ��ʳȺ�ɫ ��Ӧ���ȣ�װ��A�е��������ݳ�������CCl4�� ������ �ݳ���������Ҳ����AgNO3��Һ��Ӧ ��
��������
���Ʊ��屽��װ�ÿ�֪��A�б���Һ�巢��ȡ����Ӧ�����屽��HBr���屽������ˮ���ܶȱ�ˮ��B�����Ȼ�̼�ɳ�ȥ�ӷ��������壬C��HBr����������Ӧ����AgBr������֤�����廯�����ɣ�Ҳ�Ϳ���˵���÷�ӦΪȡ����Ӧ���ݴ˷������
(1)װ��A�����ܹ����巴Ӧ�����廯���������廯�������������巢����Ӧ�����屽����Ӧ�Ļ�ѧ����ʽ�У�2Fe+3Br2= 2FeBr3��![]() �� �ʴ�Ϊ��2Fe+3Br2= 2FeBr3��
�� �ʴ�Ϊ��2Fe+3Br2= 2FeBr3��![]() ��
��
(2)�����������Ȼ�̼�����廯�����������Ȼ�̼���ɴ�װ��C�п����������ǵ��ܿ��а������Թ����е���ɫ���廯���������ɣ�˵����Ӧ����HBr���ɣ��ʴ�Ϊ�����ܿ��а������Թ����е���ɫ�ij������ɣ���HBr���ɣ�
(3)װ��B������ƿ����ʢCCl4Һ�壬���ӷ���������CCl4��ʹCCl4�ʳ�ɫ�����û��װ��B����װ��A��Cֱ���������ݳ���������Ҳ����AgNO3��Һ��Ӧ������֤�����廯�����ɣ��ʴ�Ϊ��Һ����ɫ����Ӧ���ȣ�װ��A�е��������ݳ�������CCl4�У����������ݳ���������Ҳ����AgNO3��Һ��Ӧ��
(4)ʵ����Ϻ�A�Թ��е�Һ�嵹��װ����ˮ���ձ��У��屽������ˮ���ܶȱ�ˮ���Կ��������ֲ㣬�ձ��²�Ϊ�屽���ʴ�Ϊ���¡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���TPE���оۼ��յ��������ԣ��ڹ���������Ӧ��ǰ����������ṹ��ʽ����ͼ��ʾ�������йظ��л���˵����ȷ����
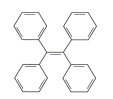
A. ����ʽΪC26H22 B. ���ڱ���ͬϵ��
C. һ�ȴ�����3�� D. ������ˮ�;ƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ı仯������������ԭ��Ӧ������
A | B | C | D | |
ʵ�� | NaOH ��Һ����FeSO4 ��Һ�� | ʯ����Һ������ˮ�� | �� K2Cr2O7 ��Һ �еμ�Ũ���� | CO2 ͨ�� Na2O2 |
���� | ������ɫ�������� �ձ�Ϊ���ɫ | ��Һ��죬���Ѹ����ɫ | ��Һ��ɫ��dz�� ��ɫ���� | ������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��п��ϡ������ɵ�ԭ����У�ͭ��________��������________��Ӧ���缫��Ӧʽ��________��п��________��������________��Ӧ���缫��Ӧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҽ��ж��������Ʊ�������ʵ������װ����ͼ��ʾ�����ּг�װ��δ������

��ش��������⣺
(1)����װ��װ�ú�����Ҫ���е�ʵ�����Ϊ_________________________________��
(2)Ϊ����SO2��Na2O2�ķ�Ӧ�Ƿ����������ɣ�װ��B��ʢ�ŵ��Լ�XӦΪ________��װ��D�м�ʯ�ҵ�������_______________________________________________��
(3)�رյ��ɼ�2�����ɼ�1��ע��70%����������û������ƿ�еĹ��壬����SO2��Na2O2��Ӧ�Ƿ����������ɵIJ�����������_____________________________________��
(4)�رյ��ɼ�1�����ɼ�2�������������װ��E��F��G�У���˵��I���Ļ�ԭ������SO2������Ϊ_________________��������Ӧ�����ӷ���ʽ��______________________��
(5)Ϊ����֤װ��E��SO2��FeCl3������������ԭ��Ӧ��ijѧ�����������ʵ�飺ȡ����װ��E�е���Һ���Թ��У������м���ϡ�����ữ��BaCl2��Һ��������ɫ���������ɴ��ж�SO2��FeCl3������������ԭ��Ӧ�����������Ƿ������________(���������������)��ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.���Ĺ��������Ȼ�B.����Ĺ��������ǻ�
C.�������Ĺ������DZ���D.Ȳ���Ĺ�������̼̼����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��Һ�д��������һ�������ǣ� ��
A.Cu2+��SO42-��OH-��K+B.Fe3+��NO3-��Cl-��H+
C.K+��CO32-��Cl-��H+D.H+��Na+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���Ժ��ܷϴ�������Co��Fe��FeO��Fe2O3�Լ�������������ʣ��Ʊ��Ȼ��ܾ������������[Na2Fe6(SO4)4(OH)12]�Ĺ������£�
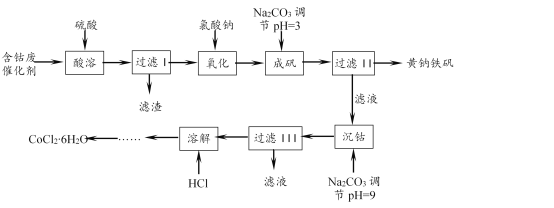
��֪��KMnO4��������ǿ����������HBr��HCl��Fe2+�ȡ�
��1�������������ɷ������ڼ��������½��С���������ʱ��Ӧ�����ӷ���ʽΪ____��ʵ�����ܷ�ѡ��KMnO4��Һ����Fe2+�Ƿ���ȫ������____����ܡ����ܡ�����������____��
��2���������£�����H2O2����������ʵ��H2O2����������������Ҫ�࣬��Ҫԭ��֮һ��H2O2�����˷ֽ⡣��������H2O2�ֽ�Ͽ��ԭ���ǣ��� ____����____��
��3���ɷ������з�Ӧ�����ӷ���ʽΪ____������ɷ��Ƿ���ȫ��ʵ�������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe2����I����Br������Һ��ͨ���������������Һ���������ӵ����ʵ����仯��ͼ��ʾ����֪��b��a��5���߶���ʾһ�ֺ����ᣬ�Ң�͢���ʾ�������к�����ͬ��Ԫ�ء�����˵������ȷ����
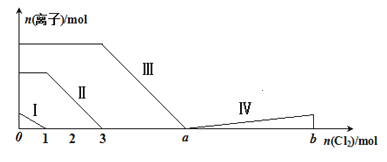
A. �߶��ʾFe2+�ı仯���
B. �߶�������Ӧ�����ӷ���ʽΪ��I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. ����ͼ��ɼ���a=6
D. ԭ��Һ��c(Fe2��)��c(I��)��c(Br��)��2��1��3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com